1.2. Классификация и характеристика примесей природных вод
Природные воды классифицируют по ряду признаков, простейший из них - солесодержание воды: пресная вода - солесодержание до 1 г/дм3; солоноватая - солесодержание 1 - 10 г/дм3; соленая - солеесодержание более 10 г/дм3. У речных и подземных вод солесодержание изменяется от 50 - 200 до 1500 - 2000 мг/дм3. Наибольшее количество растворенных примесей содержат воды океанов и морей, г/дм3: Балтийского моря - 11, Каспийского - 13, Черного - 19, Атлантического океана - 36.
Воды классифицируют также по преобладающему аниону - на гидрокарбонатную, хлоридные или сульфатные. Пресные воды относятся обычно к гидрокарбонатному классу, так как содержание гидрокарбонатов кальция и магния в них достигает 60 - 70%.
Примеси природных вод по степени дисперсности (крупности) подразделяют на истинно-растворенные (ионно- или молекулярно-дисперсные), распределенные в воде в виде отдельных ионов, молекул; коллоидно-дисперсные с размером частиц от 1 до 100 нм; грубодисперсные с размером частиц более 100 нм (0.1 мкм). Данная классификация носит условный характер. Грубодисперсные примеси воды, называемые также суспензиями или взвешенными веществами с частицами размером порядка нескольких микрометров, проявляют свойства, аналогичные коллоидным системам и их часто объединяют под общим названием микрогетерогенных систем.
Коллоидные примеси представляют собой агломераты из большого числа молекул с наличием поверхности раздела между твердой фазой и водой. Из-за малых размеров коллоидные частицы не теряют способности к диффузии и обладают значительной удельной поверхностью. Например, если кубик вещества объемом 1 см3 раздробить на более мелкие кубики с длиной ребра 10 нм, то количество таких кубиков составит 1018 единиц с общей площадью поверхности 600 м2. Коллоидные частицы не выделяются из воды под действием силы тяжести, не задерживаются обычными фильтрующими материалами (песком, фильтровальной бумагой) и различимы в рассеянном свете (конус Тиндаля). В природных водах в коллоидно-дисперсном состоянии находятся различные производные кремниевой кислоты и железа, органические вещества - продукты распада растительных и животных организмов.
Грубодисперсные примеси (так называемые взвешенные вещества) имеют столь большую массу, что практически не способны к диффузии. С течением времени устанавливается определенное седиментационное равновесие, и примеси либо выпадают в осадок, либо всплывают на поверхность (при плотности частиц меньше плотности воды).
Длительно оставаясь во взвешенном состоянии, грубодисперсные примеси обусловливают мутность воды. Чем больше размер частиц грубодисперсных примесей, тем быстрее устанавливается седиментационное равновесие и тем легче выделяются они из воды при отстаивании или фильтровании. Так, скорость отстаивания частиц песка и ила размерами 100 и 20 мкм составляет в неподвижной воде при 10°С соответственно около 7 и 0.4 мм/с.
По химическому составу примеси природных вод можно разделить на два типа: минеральные и органические.
К минеральным примесям воды относятся растворенные в ней содержащиеся в атмосфере газы N2, О2, СО2, образующиеся в результате окислительных и биохимических процессов NН3, СН4, H2S, а также газы, вносимые сточными водами; различные соли, кислоты, основания, в значительной степени находящиеся в диссоциированной форме, т.е. в виде образующих их катионов и анионов.
К органическим примесям природных вод относят гумусовые вещества, вымываемые из почв и торфяников, а также органические вещества различных типов, поступающие в воду совместно с сельскохозяйственными стоками и другими типами недостаточно очищенных стоков.
Из-за сложности индивидуальной классификации органических примесей каждого типа в практике анализа используют общую способность органических примесей окисляться под действием специфических окислителей. Этот критерий не дает точного представления о реальной концентрации органических веществ в воде, однако позволяет приближенно характеризовать и сравнивать воды различного типа.
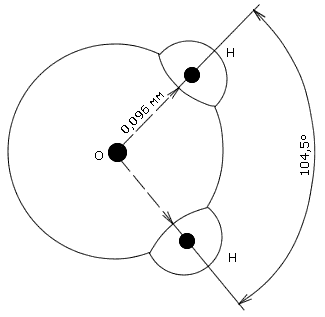
Характеристику ионизированных примесей природных вод начнем с рассмотрения электролитических свойств чистой воды и растворов. Особенностью строения молекулы Н2О является несимметричное расположение атомов водорода относительно атома кислорода (рис. 1.3).
 |
 |
| a) |
б) |
Рис. 1.3. Строение молекул воды (а) и электронных орбиталей (б)
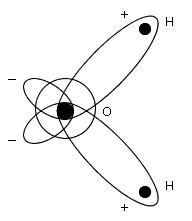
Как видно из рисунка, молекула воды нелинейна, так как центры ядер атомов лежат в вершинах треугольника. В центре молекулы воды располагается атом кислорода, а на расстоянии 0.096 нм от него - два атома водорода, образуя угол 104.5°. Электроны, образующие связи O-H смещены к более электроотрицательному атому кислорода, в результате чего атомы водорода приобретают эффективные положительные заряды (рис. 1.3, б), а сама молекула воды становится полярной. Полярность молекул H2O объясняет их способность притягиваться друг к другу за счет связи, называемой водородной, и создавать подвижные короткоживующие группировки. Водородные связи не настолько сильны, чтобы разорвать и перестроить по-новому молекулы воды, поскольку они в несколько раз слабее связей между атомами водорода и кислорода. Посторонняя частица (ион, молекула или кристалл), попав в воду, может разорвать и замкнуть на себе водородные связи, что способствует растворению этой частицы. Процесс присоединения молекулы воды к "чужим" частицам называется гидратированием и является определяющей стадией их растворения. В зависимости от растворяющегося вещества в безводном состоянии его диссоциация протекает по-разному. Так, кристалл соли с ионной структурой, например, KCl, попадая в воду, испытывает притяжение к поверхностным ионам полярной молекулы воды (ион-дипольное взаимодействие, рис. 1.4), но, если ионы притягивают к себе молекулы воды, то и последние с такой же силой притягивают к себе ионы растворяющейся соли. Одновременно притянутые молекулы воды испытывают толчки со стороны других молекул, находящихся в движении. Этих толчков вместе с тепловыми колебаниями ионов в кристалле оказывается достаточно для отделения ионов от кристалла и перехода их в раствор. Вслед за первым слоем ионов в раствор переходит следующий слой, и таким образом идет постепенное растворение кристалла.
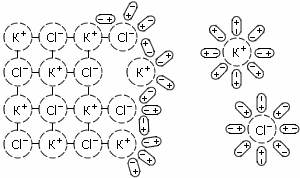
Рис. 1.4. Схема растворения соли
Иначе протекает диссоциация полярных молекул, помещенных в воду (рис. 1.5). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов - поляризуют молекулу растворяющегося вещества (например, HCl). Такая поляризация в сочетании с колебательным тепловым движением атомов в рассматриваемой молекуле, а также с непрерывным тепловым движением окружающих ее молекул H2O приводит, в конечном счете, к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются.
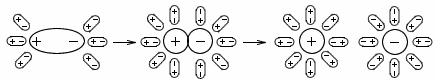
Рис. 1.5. Схема диссоциации полярных молекул в водном растворе
Вещества, распадающиеся в растворах на ионы, называются электролитами. Электролитами являются соли, кислоты, основания, а также вода.
Чистая вода является слабым электролитом. Диссоциация ее молекул описывается уравнением
Константа диссоциации воды в соответствии с законом действующих масс при 25°С
| К = аH+ · аOH- / аН2О = 1.8 · 10-16, |
(1.5) |
где аH+, аOH-, аН2О - соответственно активности ионов Н+, ОН - и молекул воды.
Активностью называется эффективная концентрация в растворе, которая в результате взаимодействия ионов (электростатического притяжения и отталкивания) имеет меньшее значение, чем фактическая. Активность ионов данного вида аi, связана с их фактической концентрацией Ci следующим соотношением:
где fi - коэффициент активности ионов данного вида. Коэффициент активности зависит от концентраций и валентностей всех ионов, находящихся в растворе, и для разбавленных растворов (до 0.1 моль/дм3) определяется по формуле Дебая-Гюккеля
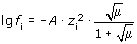 , , |
(1.7) |
где А = 1.823 · 106 / (ε · T)3/2; m - ионная сила; zi - валентность ионов данного вида; ε - диэлектрическая проницаемость; T - температура, К.
При температуре воды 298 K ε = 78.5, а коэффициент А = 0.508.
Ионная сила m характеризует меру интенсивности электрического поля, возникающего в растворе из-за наличия в нем ионов, и определяется из выражения:
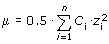 , , |
(1.8) |
где Ci - концентрация данного вида ионов в растворе, моль/дм3.
Из (1.7) и (1.8) видно, что в разбавленных растворах на значения ионной силы и коэффициента активности влияют не индивидуальный химический характер ионов, а лишь их концентрация, заряд и температура. Так, в одном и том же растворе коэффициент активности будет иметь одно значение для одновалентных ионов, другое для двухвалентных и т.д. Только в бесконечно разбавленных растворах f = 1, т.е. ai = Ci. В природных водах коэффициент активности одновалентных ионов f1 в зависимости от m составляет 0.8 - 0.95. Для двух- и трехвалентных ионов f2 и f3 находятся в интервале 0.4 - 0.8 (табл. 1.2).
Таблица 1.2
Зависимость коэффициентов активности ионов в водных растворах от ионной силы и заряда при 298 K
Онлайн расчет
| Заряд иона |
Коэффициент активности для ионной силы m |
| 0.001 |
0.0025 |
0.005 |
0.01 |
0.025 |
0.05 |
0.1 |
0.5 |
| 1 |
0.965 |
0.948 |
0.928 |
0.90 |
0.86 |
0.84 |
0.81 |
0.84 |
| 2 |
0.870 |
0.809 |
0.705 |
0.675 |
0.57 |
0.50 |
0.44 |
0.50 |
| 3 |
0.738 |
0.632 |
0.540 |
0.445 |
0.325 |
0.21 |
0.16 |
0.21 |
Для недиссоциированных молекул коэффициент активности f = 1, и в этом случае аН2О = CН2О. Если пренебречь незначительной долей диссоциированных молекул воды концентрацию недиссоциированных молекул можно принять равной общей ее концентрации, т.е. 1000 / 18 = 55.55 моль/дм3 (18 - молекулярная масса Н2О), и тогда
| aH+ · аOH- = К · CН2О = 1.8 · 55.55 · 10-14 = Kw, |
(1.9) |
где Кw - ионное произведение воды, являющееся функцией ее температуры.
Зависимость ионного произведения воды от температуры можно определить из формулы
| lgKw = -6013.79/Т - 23.6521 · lgT - 64.1013. |
(1.10) |
В любом водном растворе всегда присутствуют оба вида ионов (Н+ и ОН-). Характер среды (кислая, щелочная, нейтральная) определяется их концентрациями, причем для выражения характера среды достаточно знать какую-либо одну из них. Чаще используют водородный показатель рН, представляя его как
Для чистой воды при 22°С можно записать, что 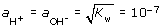 и рН = 7 (также рОН = 7); среда имеет нейтральный характер. При наличии в воде растворенных примесей рН может принимать значения ниже нейтрального - среда кислая и выше - среда щелочная.
и рН = 7 (также рОН = 7); среда имеет нейтральный характер. При наличии в воде растворенных примесей рН может принимать значения ниже нейтрального - среда кислая и выше - среда щелочная.
Значение рН в природной воде целиком определяется характером и концентрацией примесей в ней. Те примеси, которые представлены в воде сильными электролитами, полностью диссоциированы и находятся в ионной форме, у слабых электролитов только часть молекул диссоциирует и соотношение между ионами и молекулами определяется константой диссоциации (например, как у воды).
Пример 1.1. Онлайн расчет: MAS 11 MCS 14 Скачать Mathcad 14 файл Вычислить рН 0.05 М раствора серной кислоты при 298 К.
Ионная сила такого раствора
m = 0.5 · (2 · 0.05 · 12 + 0.05 · 22) = 0.15.
Коэффициент активности для одновалентных ионов
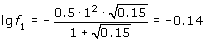 ,
,
откуда f1 = 0.725.
Тогда активность ионов Н+
aH+ = CH+ · fi = 0.05 · 2 · 0.725 = 7.25 · 10-2 моль/дм3,
а рН = 1.14.
Пример 1.2. Онлайн расчет Вычислить рН раствора, содержащего 0.01 М NaCl и 0.02 М H2SO4.
Ионная сила раствора
m = 0.5 · (0.01 · 12 + 0.01 · 12 + 0.02 · 2 · 12 + 0.02 · 22) = 0.07.
Коэффициент активности
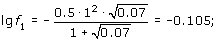 ,
,
откуда f1 = 0.785.
Активность ионов Н+
aH+ = 0.02 · 2 · 0.90 = 3.14 · 10-2 моль/дм3,
рН = 1.44.
Пример 1.3. Онлайн расчет Вычислить рН 0.2 М раствора NH4OH.
Так как аммиак - слабое основание, он диссоциирует в воде не полностью. Константа его диссоциации K = 1.8 · 10-5. При столь малом значении константы диссоциации допустимо принять fi = 1.
Тогда
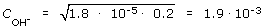 , моль/дм3
, моль/дм3
и значение рОН = 2.72.
Так как рН + рОН = 14, то значение рН = 14 - 2.72 = 11.28.
Возвращаясь к характеристике ионизированных примесей природных вод отметим, что механизм поступления примесей в природную воду формирует определенное постоянство типа важнейших ионов, содержащихся в различных водотоках и водоемах. Сведения о наиболее распространенных в природных водах ионах и их концентрациях приведены в табл. 1.3.
Таблица 1.3
Важнейшие ионы природных вод
| Группа |
Катион |
Анион |
Концентрация, мг/дм3 |
| I. |
Na+, K+, Ca2+, Mg2+ |
HCO3-, Cl-, SO42- |
От нескольких единиц до десятков тысяч |
| II. |
NH4+, Fe2+, Mn2+ |
HSiO3-, F-, NO3-, CO32- |
От десятых долей до единиц |
| III. |
Cu2+, Zn2+, Ni2+, Al3+ |
HS-, J-, NO2-, H2PO4- |
Менее десятых долей |
Ионы натрия и калия с анионами природных вод не образуют труднорастворимых простых солей, практически не подвергаются гидролизу, поэтому их относят к группе устойчивых примесей. Концентрация Na+ и К+ изменяется только в результате испарения или разбавления природной воды, при анализе воды ее часто выражают суммарно.
Ионы кальция и магния относятся к числу важнейших примесей воды и во многом определяют возможность ее использования для различных народнохозяйственных целей, так как эти ионы образуют труднорастворимые соединения с некоторыми находящимися в воде анионами. При использовании природной воды и связанном с этим изменении исходных концентраций катионов и анионов, например при упаривании или снижении растворимости с ростом температуры, может происходить выделение труднорастворимых солей кальция и магния на теплопередающих поверхностях в виде твердой фазы. Произведения растворимости некоторых труднорастворимых соединений Ca и Mg при различных температурах приведены в табл. 1.4.
Таблица 1.4
Значение произведений растворимости некоторых труднорастворимых соединений в зависимости от температуры воды, (моль/дм3)2
Онлайн расчет
| Соединение |
Температура, °С |
| 20 |
25 |
50 |
80 |
100 |
150 |
| Ca(OH)2 |
1.32·10-6 |
9.37·10-6 |
5.68·10-6 |
2.40·10-6 |
1.47·10-7 |
2.68·10-8 |
| CaCO3 |
9.51·10-9 |
6.05·10-9 |
2.37·10-9 |
1.00·10-9 |
- |
1.41·10-11 |
| Mg(OH)2 |
9.40·10-11 |
6.10·10-11 |
1.36·10-11 |
0.51·10-11 |
0.28·10-11 |
0.05·10-11 |
| CaSO4·2H2O |
- |
4.17·10-5 |
3.87·10-5 |
2.95·10-5 |
2.38·10-5 |
- |
В технологических процессах подготовки воды для снижения концентрации ионов кальция и магния часто используется образование их труднорастворимых соединений, выводимых из воды до поступления ее в водопаровой тракт.
Ионы железа могут находиться в природной воде в основном в виде ионов Fe2+, которые с большинством ионов не образуют труднорастворимых солей и в сравнительно малой степени подвергаются гидролизу. При повышенных концентрациях растворенного О2 (приповерхностные слои воды) ионы Fe2+ окисляются до ионов Fe3+ которые легко подвергаются гидролизу с образованием труднорастворимого Fе(ОН)3, поэтому в поверхностных водах железо находится в коллоидной форме, а в глубинных - в истинно-растворенном состоянии, обычно в виде гидрокарбоната двухвалентного железа Fе(НСО3)2. В поверхностных водах железо также входит в состав органических соединений.
Ионы С1- и SO42- в природной воде относятся к числу устойчивых примесей, так как они не образуют труднорастворимых соединений и не подвергаются гидролизу, однако в присутствии большого количества органических примесей (сброс сточных вод) и при дефиците кислорода в результате протекания биохимических процессов ионы SO42- могут легко восстанавливаться до Н2S или S. Последние при изменении кислородного режима водоема легко окисляются снова до SO42-.
Кремниевая кислота находится в природной воде в основном в недиссоциированном состоянии, так как ее диссоциация становится заметной лишь при значении рН > 8. Ангидрид кремниевой кислоты SiO2 образует с водой ряд кислот с общей формулой xSiO · yH2O-. Это могут быть метакремниевая (х = 1; y = 1), ортокремневая (х = 1; y = 2) и поликремневые (при х > 1). Содержание кремниевой кислоты в воде существенно зависит от ионного состава воды. Так, присутствие в воде ионов кальция и магния приводит к образованию малорастворимых силикатов, что снижает концентрацию кремниевой кислоты. Кремниевые кислоты практически нерастворимы в природной воде и образуют в ней коллоидные растворы. При рН > 8 часть кремниевых кислот существует в воде в истинно растворенном состоянии, причем с повышением рН степень их диссоциации возрастает.
При многообразии форм кремниевой кислоты в воде целесообразнее не идентифицировать их, а определять в виде суммарного кремнесодержания воды, которое в поверхностных водах обычно составляет от 1 до 30 мг/дм3.
Анионы угольной кислоты (НСО3- и СО32-) являются одними из важнейших анионов в природных водах, во многом определяющих поведение различных примесей в них, а также в технологических процессах очистки воды. В природных водах содержится одновременно несколько форм угольной кислоты, а именно СO2, Н2СО3, НСО3 - СО32-. Так как в чистой воде концентрация Н2СO3 составляет около 0.2% от общества количества растворенного СО2, то обычно концентрация угольной кислоты выражается через СО2. В воде угольная кислота диссоциирует по двум ступеням с образованием гидрокарбонатных и карбонатных ионов:
| H2CO3 « H+ + НСО3-, |
(1.12) |
| НСО3- « H+ + СО32-. |
(1.13) |
Таким образом, в воде одновременно присутствуют гидрокарбонат-ионы, карбонат-ионы и свободная углекислота. Концентрации углекислоты в этих формах взаимосвязаны и могут быть определены из констант диссоциации углекислоты по первой и второй ступеням:
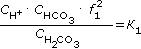 , , |
(1.14) |
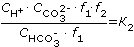 , , |
(1.15) |
где К1 и К2 - соответственно истинные константы диссоциации угольной кислоты по первой и второй ступеням (табл. 1.5), f1, f2 - коэффициенты активности одно- и двухзарядных ионов.
Таблица 1.5
Константы диссоциации угольной кислоты по первой и второй ступеням
Онлайн расчет
| Температура воды, °С |
KI, 10-7 |
pKI |
KII, 1011 |
pKII |
| 0 |
2.65 |
6.579 |
2.36 |
10.625 |
| 10 |
3.43 |
6.464 |
3.24 |
10.420 |
| 20 |
4.15 |
6.381 |
4.20 |
10.377 |
| 25 |
4.45 |
7.352 |
4.69 |
10.329 |
| 30 |
4.71 |
6.327 |
5.13 |
10.290 |
| 40 |
5.06 |
6.298 |
6.03 |
10.220 |
| 60 |
5.02 |
6.299 |
7.20 |
10.143 |
| 80 |
4.21 |
6.376 |
7.55 |
10.122 |
Примечание. PK - отрицательный десятичный логарифм константы диссоциации.
При почленном делении этих уравнений получаем выражение взаимосвязи форм угольной кислоты в виде
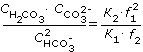 . . |
(1.16) |
Из уравнений (1.16) следует, что соотношение между СO2, НСО3- и CO3- при данной температуре зависит от концентрации водородных ионов, т.е. значения рН. Результаты расчетов по уравнению (1.16) приведены в табл. 1.6 и рис. 1.6.

Рис. 1.6. График соотношения молярных концентраций различных форм угольной кислоты в зависимости от рН при 25°С
Таблица 1.6
Соотношение СО2, НСО3-, СО32- в зависимости от рН
| Форма угольной кислоты |
Содержание угольной кислоты, в том числе СО2 в воде (%) при значении рН |
| 5 |
6 |
7 |
8 |
9 |
9.5 |
10 |
| Н2СО3 |
100 |
69 |
18 |
2.2 |
0.2 |
- |
- |
| НСО3- |
- |
31 |
82 |
97.2 |
95.2 |
87 |
68 |
| СО32- |
- |
- |
- |
0.5 |
4.6 |
13 |
32 |
Примечание. Mathcad-документ, по которому рассчитываются соотношения CО2, HCO3-, CO32- в зависимости от рН, хранится на сайте www.vpu.ru в файле с именем Form_CO2.mcd.
В природных водах (рН » 7) содержится угольная кислота (свободная) и ионы НСО3-, ионы СО32- практически отсутствуют. При значении рН ³ 9 угоньная кислота полностью связана, свободная углекислота отсутствует.
Существующее между различными формами угольной кислоты равновесие суммарно выражается уравнением:
| 2HCO3- = CO32- + H2CO3 = CO3- + CO2 + H2O. |
(1.17) |
Из этого уравнения следует, что для поддержания в растворе (природной воде) определенной концентрации НСО3 требуется, чтобы в воде присутствовало эквивалентное этой концентрации количество свободной "равновесной углекислоты" СO2. Так как растворимость СO2 зависит от температуры и парциального давления СO2 в воздухе, контактирующем с раствором, а также от протекания биохимических процессов в природных водах, при определенных условиях содержание СО3 в воде может оказаться меньше или больше значения, соответствующего расчетному равновесному содержанию ее в системе НСО3- - СO2. Это приведет к смещению равновесия по уравнению (1.17) вправо или влево и вызовет изменение концентрации СО32- по отношению к его равновесному значению. Система (т.е. природная вода, содержащая Са2+ + НСО3, СО2, СО2), может оказаться неустойчивой и в ней самопроизвольно начнут протекать процессы, приводящие к восстановлению равновесия (принцип Ле-Шателье) и сопровождающиеся выделением из раствора твердой фазы СаСО3 (избыток ионов CO32-) либо растворением твердой фазы СаСО3 (недостаток по отношению к равновесному значению ионов СO32-). На этом основании воду с фактическим (определенным аналитически) содержанием СO2, равным ее расчетной по уравнению (1.17) равновесной концентрации, называют стабильной. При содержании СO2, большем ее равновесной концентрации, избыток ее способен вызывать растворение СаСО3 при контакте воды, например, с бетонными сооружениями, доломитовыми и известняковыми породами, поэтому такую воду называют агрессивной. Наоборот, при недостатке СO2 по сравнению с равновесной концентрацией будет наблюдаться распад части гидрокарбонатных ионов с образованием дополнительного количества карбонатных ионов и выделением из системы твердой фазы карбоната кальция по уравнению:
| Ca2+ + CO3- « CaCO3(т). |
(1.18) |
Такую воду называют нестабильной.
Фактические значения рН, связанные с содержанием в воде различных форм Н2СО3 при их эксперементальном определении, могут относиться к значению рН в положении равновесия как рНфакт < рНравн, так и рНфакт > рНравн. Разность между экспериментально найденным значением рНфакт и рНравн называется индексом стабильности воды:
| Иc = рНфакт - рНравн. |
(1.19) |
При значении Иc = 0 вода стабильна, при Иc < 0 вода агрессивна, а при Иc > 0 она нестабильна и способна к образованию отложений. Экспериментально стабильность воды можно определить также путем контактирования пробы воды с карбонатом кальция в течение 1 - 2 ч и измерения значения рН до (pH1) и после (рН2) контактирования. При этом принимается, что если отношение pH1/pH2 = 1, то вода стабильна. При pH1/pH2 > 1 вода нестабильна, а при pH1/pH2 < 1 она агрессивна.
Концентрацию равновесного диоксида углерода в зависимости от щелочности и рН природной воды в пределах 5.5 - 8.3 можно определить по упрощенной формуле (1.19), полученной совместным решением уравнений (1.5) и (1.8)
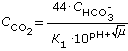 , , |
(1.20) |
где CCO2 - содержание в воде свободного диоксида углерода, мг/дм3; CHCO3 - концентрация бикарбонатов в воде, мг-экв/дм3. Формулу (1.20) можно представить приближенно в виде зависимости:
| CCO2 = a · (CHCO3)3, |
(1.21) |
в которой для вод с солесодержанием 100 - 400 мг/дм3 a = 0.268.
Кроме рассмотренных примесей природные воды содержат микроорганизмы (бактерии, вирусы, простейшие беспозвоночные и т.п.), большая часть из которых является полезными и участвует в процессе разложения и окисления органических и минеральных веществ, способствуя тем самым самоочищению водоемов. Меньшая часть бактерий, называемых патогенными (бациллы лихорадки, холеры, дизентерии и т.п.) способны размножаться в организмах человека и животных, вызывая в связи с этим болезни различной тяжести. Наличие патогенных микроорганизмов контролируется при бактериологическом анализе питьевой воды.





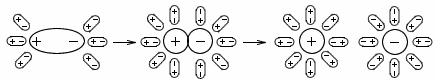
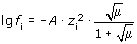 ,
,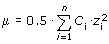 ,
,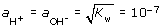 и
и 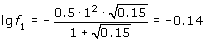 ,
,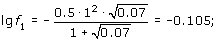 ,
,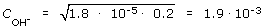 , моль/дм3
, моль/дм3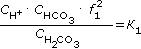 ,
,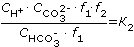 ,
,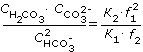 .
.
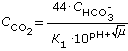 ,
,