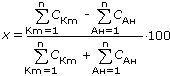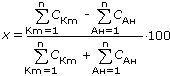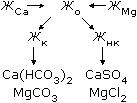1.4. Показатели качества воды
В зависимости от характера использования воды различными потребителями определяются концентрационные показатели, необходимые для качественной и количественной характеристики воды.
Прежде чем приступить к детализации концентрационных показателей качества воды с расчетными примерами, отметим, что действующая научно-техническая, справочная литература и производственные документы (ПТЭ, руководящие и методические указания, справочники, учебники, эксплуатационные инструкции и т.п.) используют для выражения концентрация ряда растворов единицы г-экв/дм3, мг-экв/дм3, относящиеся к эквивалентной концентрации. В то же время в Международной системе единиц (СИ) за единицу количества вещества принят моль, что исключает формально понятие "эквивалентной концентрации" (хотя закон эквивалентов никто не отменял), но разрешает использование концентраций, выраженных в нормальностях. Последняя базируется на молярной концентрации эквивалента, обозначаемого, например, Cэк(H2SO4) = 1 моль/дм3 и соответствует 1 н раствору H2SO4. Массовую и объемную концентрацию вещества допустимо выражать в ранее используемых единицах. Для того чтобы при изучении материалов "Водоподготовки" не было разночтений с действующими документами и литературой, в книге сохранены эквивалентные единицы. При этом надо учитывать, например, что Cэк = 0.1 моль/дм3 = 0.1 н = 0.1 г-экв/дм3 = 100 г-экв/дм3. Поясним вышеизложенное примером.
Пример 1.4. Рассчитать, сколько граммов Na2SO4 потребуется для приготовления 400 см3 растворов:
1) 0.3 М Онлайн расчет;
2) 0.3 н Онлайн расчет;
3) с массовой долей 16% (насыщенный раствор r = 1.141 г/см3) Онлайн расчет.
Решение.
1) молярная масса Na2SO4 MNa2SO4 = 142 г/моль. По определению в 1 дм3 0.3 М раствора содержится 0.3 моля Na2SO4, соответственно в 400 см3 раствора - 0.12 моля соли. Следовательно, для приготовления заданного объема 0.3 М раствора нужно взять 142 · 0.12 = 17.04 г Na2SO4.
2) эквивалент ЭNa2SO4 = (1/2) Na2SO4, поэтому молярная масса эквивалента Мэк(Na2SO4) = 1/2 · 142 = 71 г/моль. По аналогии с предыдущим расчетов MNa2SO4 = 71 · 0.12 = 8.52, т.е. для приготовления 400 см3 0.3 н раствора (0.3 г-экв/дм3) необходимо 8.52 г Na2SO4.
3) по определению, в растворе с массовой долей 16% растворенная соль Na2SO4 составляет 16% от общей массы раствора. Определим массу 400 см3 насыщенного раствора и возьмем от нее 16%. Учитывая, что по условию, плотность такого раствора r = 1.141 г/см3, масса раствора равна 1.141 · 400 = 456.4 г. Масса соли должна быть равна 456.4 · 16/100 = 73.02 г.
Отметим также, что при выражении концентраций имеются расхождения, связанные с их выражением по отношению к дм3, кг, л. При плотности анализируемого раствора, близкой к 1 кг/дм3, значения массовой и объемной концентрации одинаковы.
Важнейшими показателями качества воды для использования ее в теплоэнергетике являются:
1) концентрация грубодисперсных примесей (ГДП);
2) концентрация истинно-растворенных примесей (ионный состав);
3) концентрация коррозионно-активных газов;
4) концентрация ионов водорода;
5) технологические показатели, в которые входят сухой и прокаленный остаток, окисляемость, жесткость, щелочность, кремнесодержание, удельная электропроводимость и т.д.
Концентрация грубодисперсных веществ в воде может быть достаточно точно определена фильтрованием воды через бумажный фильтр с последующим его высушиванием при температуре 105 - 110°С до постоянной массы. Однако на практике предпочитают использовать методы определения грубодисперсных веществ по прозрачности или мутности воды. Прозрачность воды определяют при повышенных концентрациях ГДП в воде при помощи стеклянной трубки, залитой водой, на дне которой расположен стандартный шрифт или крест с шириной линий 1 мм. Высота столба воды, при которой определяется хорошая видимость шрифта или креста, является количественной оценкой прозрачности воды. Норма прозрачности питьевой воды "по шрифту" равна 30 см. При малых концентрациях ГДП (< 3 мг/дм3) используют нефелометрический метод, основанный на сравнении мутности анализируемой воды с соответствующим эталоном. Концентрация ГДП может быть также определена по разности значений плотного и сухого остатков, полученных при упаривании 1 дм3 соответственно нефильтрованной и фильтрованной воды и высушивании остатка при 110°С до постоянной массы.
Сухой остаток позволяет косвенно судить о солесодержании воды, т.е. о сумме всех анионов и катионов в воде, за исключением ионов Н+ и ОН-. Однако при образовании сухого остатка несколько изменяется ионный состав примесей за счет разложения гидрокарбонатов. В сухой остаток входит также часть органических и коллоидных примесей. Прокаливание сухого остатка при 800°С приводит к сгоранию органических примесей и распаду карбонатов. Поэтому разность значений плотного и сухого остатков позволяет лишь ориентировочно оценить концентрацию органических примесей в воде. На практике предпочитают определять концентрацию органических примесей в воде косвенным методом, используя сильные окислители (например, КМnО4). Поэтому концентрацию органических примесей называют окисляемостью воды и выражают через расход окислителя, необходимого в стандартных условиях для окисления органические примесей, содержащихся в 1 дм3 воды.
Концентрации отдельных ионов в воде, мг/дм3 (или г-экв/дм3) определяют методами химического анализа. Правильность проведения анализа должна подтверждаться выполнением закона электронейтральности SА = SК, г-экв/дм3. Возможная ошибка при этом не должна превышать 1%:
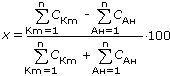 |
(1.22) |
Если ошибка превышает 1%, то следует проверить качество анализа отдельных ионов или повторить весь анализ.
Суммарная концентрация всех катионов и анионов в воде составляет солесодержание воды, при этом не учитываются анионы кремниевой кислоты из-за неопределенности сведений об их концентрации в ионной форме, полуторные оксиды и ионы Н+ и ОН-. В случае кислых или щелочных растворов ионы H+ и ОН- следует учитывать при подсчете солесодержания.
Жесткость воды является одним из важнейших показателей, определяющих пути использования воды в теплоэнергетике. Общей жесткостью воды Жo называется суммарная концентрация ионов кальция и магния, выражаемая в г-экв/дм3, а при малых значениях - в мкг-экв/кг. По определяющему катиону общая жесткость воды подразделяется на кальциевую ЖСа и магниевую ЖMg. Часть общей жесткости (в предельном случае при СНСО3- > Жо вся жесткость), эквивалентная концентрации гидрокарбонат-ионов и карбонат-ионов в воде, называется карбонатной жесткостью Жк, а остальная часть, эквивалентная содержащимся в воде другим анионам (С1-, SO42 - и др.), называется некарбонатной жесткостью Жнк:
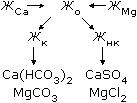
Подчеркнем еще раз, что при СНСО3- + СО32- > ССа2+ + Mg2+ принимается, что Жо = Жк, а Жнк = 0. По значению Жо, (г-экв/дм3) природных вод установлена следующая классификация: Жо < 1.5 - малая жесткость; Жо = 1.5 - 3.0 - средняя; Жо = 3.0 - 6.0 - повышенная; Жо = 6.0 - 12.0 - высокая; Жо > 12.0 - очень высокая. Жесткие воды образуют плотные отложения на теплопередающих поверхностях. Процесс выделения из воды ионов кальция и магния получал название умягчение.
Пример 1.5. Онлайн расчет Жесткость исходной воды составляет 4 г-экв/дм3, а ССа2+ = 60 мг/дм3. Определить магниевую жесткость и концентрацию магния в воде.
Общая жесткость определяется соотношением

Из итого равенства находим ЖMg = 4 - 3 = 1 г-экв/дм3. Следовательно, СMg = 12 мг/дм3.
Пример 1.6. Онлайн расчет Качество исходной воды характеризуется следующими данными: Жо = 5 г-экв/дм3, Жнк = 2 г-экв/дм3. Определить Жк, ЖСа и ЖМg, если Жо/ЖMg = 4.
Карбонатную жесткость находим из равенства
Жк = Жо - Жнк = 5 - 2 = 3 г-экв/дм3;
ЖMg = Жо/4 = 1.25 г-экв/дм3,
тогда кальциевая жесткость равна
ЖСа = Жо - ЖMg = 5 - 1.25 = 3.75 г-экв/дм3.
Общей щелочностью воды Що г-экв/дм3, называется суммарная концентрация всех анионов слабых кислот и ионов гидроксида за вычетом концентрации ионов водорода:
| Що = SCAнсл.к + СОН- - СH+. |
(1.23) |
Характер анионов слабых кислот, обусловливающих общую щелочность, позволяет подразделять ее на гидратную щелочность (равную концентрации ионов ОН-), гидрокарбонатную (НСО3-), карбонатную (CO32-), силикатную (НSiO3-, SiO32-) и фосфатную (Н2РО4-, HPO42-, РО43-).
Обычно в природных водах гидрокарбонатная щелочность существенно преобладает над другими видами щелочности, поэтому ее значение без большой погрешности выражает общую щелочность воды. Так как аналитически достаточно надежно определяемым значением щелочности можно считать 0.01 г-экв/дм3, учет гидратной щелочности следует проводить лишь при СОН- > 10-2 г-экв/дм3, т.е. при рН > 9.
Экспериментально щелочность воды определяют титрованием пробы воды кислотой в присутствии кислотно-щелочных индикаторов фенолфталеина и метилового оранжевого, меняющих свою окраску соответственно при рН = 8.3 и 4.4. Обозначив через Ф количество кислоты, израсходованной при титровании по фенолфталеину и через М суммарных расход кислоты по фенолфталеину и метиловому оранжевому с учетом мольных переходов СО32- ® НСО3- ® Н2СО3 (см. табл. 1.6), получим данные для определения вида щелочности воды, приведены в табл. 1.7.
Таблица 1.7
Определение видов щелочности при титровании
| Соотношение между Ф и М |
В воде присутствуют ионы |
Щелочность |
| гидратная |
карбонатная |
бикарбонатная |
| M = Ф |
ОН- |
Ф (= M) |
- |
- |
| M < 2Ф |
ОН - и СО32- |
2Ф - M |
2(M - Ф) |
- |
| M = 2Ф |
СО32- |
- |
M (= 2Ф) |
- |
| M > 2Ф |
СО32 - и НСО3- |
- |
2Ф |
M - 2Ф |
| Ф = 0 |
НСО3- |
- |
- |
M |
Пример 1.7. Онлайн расчет: MAS 11 MCS 14 Скачать файл Mathcad 14 Состав примесей воды, г-экв/дм3: СCа2+ = 3; CMg2+ = 1; CNa+ = 1; CНСО32- = 3; CSO42- = 1; CCl- = 1. Определить жесткость и щелочность воды.
Проверим правильность представленного анализа:
SKm = SAн = 3 + 1 + 1.
Общая жесткость воды:
Жo = ЖCа + ЖMg = 3 + 1 = 4 г-экв/дм3,
где ЖCа = 3 мг-экв/дм3; ЖMg = 1 мг-экв/дм3.
Щелочность воды:
Щo = CНСО3- = 3 г-экв/дм3 и Жк = Щo = 3; Жнк = Жo - Жк = 4 - 3 = 1 г-экв/дм3.
Пример 1.8. Онлайн расчет В 5 дм3 бидистиллята растворили 0.4 г NaOH и 265 мг Na2CO3. Определить значение и характер щелочности раствора.
Поскольку в растворе содержаться только ионы ОН- и СО32-, то общая щелочность состоит из гидратной и карбонатной. Вначале определяем концентрацию растворенных веществ в 1 дм3:
СNaOH = 400/5 = 80 мг/дм3, СNa2СO3 = 265/5 = 53 мг/дм3,
после чего
Щг = 80/40 = 2 г-экв/дм3, Щк = 53/53 = 1 г-экв/дм3,
где 40 и 53 - молярные концентрации эквивалентов NaOH и Na2CO3.
Що = Щг + Щк = 2 + 1 = 3 г-экв/дм3.
Удельная электропроводимость воды, См/см, характеризуется электрической проводимостью слоя воды, находящегося между двумя противоположными гранями куба с ребром, равным 10-2 м. Она косвенно связана с суммарной концентрацией примесей в истинно растворенном состоянии (солесодержанием). В чистой воде, не содержащей примесей, перенос зарядов осуществляется лишь ионами Н+ и ОH-. Удельная электропроводимость такой воды при 20°C составляет 0.04 мкСм/см. В растворах связь между электропроводимостью и концентрацией ионных примесей зависит от множества факторов, в том числе от температуры, вида ионов, степени диссоциации, что существенно затрудняет измерения. Более определенная связь существует в растворах (проводниках второго рода) при постоянных температуре и степени диссоциации.
Так, удельную электропроводность водных растворов различных солей концентрацией до 500 мг/дм3 в условном пересчете на NaCl можно примерно оценить из соотношения:
| 1 мкСм/см » 0.6 мг/дм3. |
(1.24) |
Концентрация растворенных газов в воде зависит от множества факторов: природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, рН воды и т.п. Это во многих случаях существенно затрудняет их аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация свободной СО2 в природной воде находится в пределах 10 - 50 мг/дм3 при 20°C. Концентрация О2 в значительной степени зависит от содержания в воде органических веществ и температуры. При увеличении температуры от 0 до 35°C концентрация кислорода в чистой воде уменьшается от 14.6 до 6.5 мг/дм3.