2.2. Коагуляция коллоидных примесей воды
Если очистка воды от тяжелых ГДП может быть принципиально осуществлена под действием силы тяжести обычным отстаиванием, время которого определяется размером и удельной массой частиц (табл. 2.1), то коллоидные примеси за счет их особого свойства (агрегативной устойчивости) могут быть выделены из воды только методом коагуляции.
Таблица 2.1
Время осаждения различных частиц в вертикальном столбе воды высотой 1 м
| Материал или организм |
Диаметр частицы, мм |
Время осаждения |
Материал или организм |
Диаметр частицы, мм |
Время осаждения |
| Гравий |
10 |
1 с |
Глина |
0.01 |
2 часа |
| Песок |
1 |
10 с |
Бактерия |
0.001 |
8 суток |
| Мелкий песок |
0.1 |
2 мин |
Частица коллоидного размера |
0.0001 |
2 года |
Коагуляция - физико-химический процесс слипания коллоидных частиц под действием сил молекулярного притяжения с образованием грубодисперсной макрофазы (флокул) с последующим выделением ее из воды. В практике водоподготовки под коагуляцией понимают очистку воды от коллоидных веществ с одновременной очисткой от грубодисперсных примесей и обесцвечиванием воды путем дозировки в обрабатываемую воду специального реагента - коагулянта.
Для коллоидных частиц характерны:
- наличие межфазной поверхности с водой (поверхностного слоя) и связанного с этим поверхностного натяжения s;
- высокая степень дисперсности (раздробленности), которая может выражаться отношением межфазной поверхности к объему тела, т.е. удельной площадью поверхности или величиной, обратной минимальному размеру. Например, если 1 см3 вещества раздробить на частицы коллоидных размеров с гранями 1 нм (10-7 см), то число таких частиц составит 1021, их Sуд = 6000 м2/см3, а дисперсность будет равна 107 см-1.
Для оценки агрегативной устойчивости (стабильности) коллоидных систем и приемов дестабилизации рассмотрим следующие положения.
Произведение s · S равно величине поверхностной энергии G коллоидной системы, которая стремится уменьшить избыток этой энергии за счет снижения поверхностного натяжения путем избирательной адсорбции других веществ (ионов) из раствора или диссоциации поверхностных молекул коллоидной частицы. Этот процесс формирует структуру поверхностного слоя частицы и наделяет этот слой особыми свойствами. Каждая коллоидная частица сорбирует из раствора ионы одного знака заряда, которые равномерно распределяются в поверхностном слое коллоида. Адсорбированные ионы называются потенциалообразующими, они входят в состав адсорбционного слоя. Адсорбционный слой может также формироваться, как отмечалось, при частичной диссоциации поверхностных молекул вещества коллоидной частицы. Состав такого слоя зависит от химической природы коллоидов и pH среды. Агрегат коллоидной частицы вместе с адсорбционным слоем называется гранулой.
Ввиду наличия у гранулы электрического заряда вокруг нее концентрируются в растворе ионы с зарядами противоположного знака (противоионы). Не имея прочной связи с гранулой, противоионы сохраняют способность к диффузии в окружающий раствор, образуя вокруг гранулы диффузионный слой, в котором концентрация противоионов уменьшается по мере удаления от гранулы (рис. 2.1). Гранула вместе с диффузионным слоем называется мицеллой. Как видно из рис. 2.1 раствор, в котором находится коллоидная система, теряет адсорбированные потенциалообразующие ионы и обогащается противоионами. Таким образом, возникает двойной электрический слой, обуславливающий разность потенциалов j на межфазной поверхности. В неподвижном состоянии (условном) мицелла является электронейтральной.
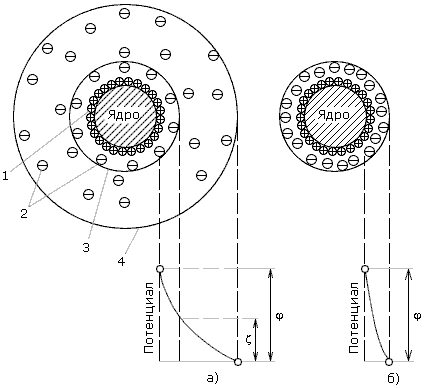
Рис. 2.1. Строение мицеллы и двойного электрического слоя:
а – x–потенциал больше нуля; б – изоэлектрическое состояние, x = 0; 1 – потенциалообразующие ионы; 2 – противоионы; 3 – граница скольжения; 4 – граница диффузного слоя
Толщина диффузного слоя l, м для симметричновалентного электролита равна:
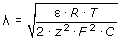 , , |
(2.1) |
где F = 96487 Кл/моль - постоянная Фарадея; R = 8.31 Дж/(моль·К) - универсальная газовая постоянная; ε - диэлектрическая проницаемость среды; z - заряд иона; C - концентрация ионов в растворе, моль/дм3; T - температура, К.
Значение λ зависит от температуры раствора, концентрации и заряда ионов, т.е. является изменяющейся величиной. Например, для водных растворов с температурой 20°C в присутствии одновалентных катионов и анионов в концентрациях C = 10-1, 10-3 и 10-5 моль/дм3 толщина диффузного слоя l для коллоидных частиц составляет соответственно 1, 10 и 100 нм.
При тепловом движении молекул воды коллоидные частицы воспринимают их воздействие и вовлекаются в молекулярно-кинетическое (Броуновское) движение, при котором вместе с коллоидной частицей движется двойной электрический слой с частью противоионов диффузного слоя, содержащихся в оболочке воды. Остальные противоионы отрываются от движущейся частицы, оставаясь во внешней части за границей скольжения. Это приводит к возникновению электрокинетического потенциала или дзета x-потенциала между движущейся коллоидной частицей и раствором (рис. 2.1, а). Значение x-потенциала зависит от количества противоионов, увлекаемых частицей; с их увеличением x-потенциал уменьшается. Рост концентрации противоионов в растворе должен приводить к увеличению их концентрации в оболочке воды, окружающей частицу и, следовательно, к снижению x-потенциала. В пределе повышение концентрации противоионов может привести к перезарядке частицы, т.е. изменению знака заряда. Естественно, что существует определенная концентрация противоионов, при которой x-потенциал становится равным нулю (рис. 2.1, б), pH среды при этом носит название pH изоэлектрической точки. Экспериментально величину электрокинетического потенциала определяют методом электрофореза. Для расчета x-потенциала, В, коллоидных частиц, находящихся в разбавленных водных растворах (природных водах) используют соотношение, полученное преобразованием уравнения Гельмгольца:
| x = 1.42 · 106 · Uэф, |
(2.2) |
где Uэф - электрофоретическая подвижность, м2/(c·В). Опытные значения Uэф составляют около 5 · 10-8 м2/(c·В), поэтому в соответствии с (2.2) x-потенциал коллоидов природных вод составляет около 70 мВ.
Типичными коллоидно-дисперсными примесями природных вод являются многоатомные органические кислоты (гуминовая и пр.) и их соли, поликремневые кислоты. Коллоидные частицы этих веществ приобретают заряд в основном за счет диссоциации поверхностных молекул, степень которых зависит от pH раствора. Так как pH природных вод обычно находится в пределах 6.8 - 8.0 единиц, что выше pH изоэлектрической точки, равным 3.5 - 4.5, для перечисленных коллоидных примесей (кислот), то они диссоциируют с приобретением гранулой отрицательного знака x-потенциала. Таким образом, основная масса коллоидных частиц в природных водах несет одинаковый отрицательный заряд и между ними действуют электростатические силы отталкивания (кулоновское взаимодействие), препятствующие их сближению. Устойчивости коллоидных систем способствует также удержание молекул воды ионами, входящими в состав двойного электрического слоя, с образованием гидратного слоя, препятствующего столкновению частиц друг с другом.
Одновременно с кулоновскими силами на коллоидные частицы действуют силы молекулярного притяжения (силы Ван-дер-Ваальса), поэтому агрегативная устойчивость коллоидных систем определяется соотношением между силами притяжения и отталкивания частиц.
Молекулярная сила притяжения Fпр двух сферических частиц радиусом r находящимися на расстоянии L (между их центрами) выражается:
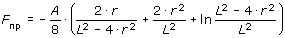 , , |
(2.3) |
где A - константа Гамакера, приблизительно равная 10-6 Вт. Отметим, что Fпр обратно пропорциональна квадрату расстояния. Приведенная зависимость упрощается при сближении частиц до очень малого расстояния:
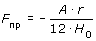 , , |
(2.4) |
где H0 = L - 2r - расстояние между крайними точками сближающихся сфер.
Сила отталкивания Fот заряженных частиц при условии, что H0 << r, описывается так:
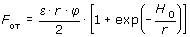 , , |
(2.5) |
где j - потенциал двойного электрического слоя.
Отметим, что Fот(H0) уменьшается с увеличением расстояния по экспоненциальному закону. Характер изменения сил отталкивания (1) и притяжения (2) показан на рис. 2.2. Результирующая кривая F(H0) (3) получена путем геометрического сложения соответствующих ординат. При минимальных и больших расстояниях, когда экспонента убывает значительно быстрее, чем степенная функция, между частицами преобладает энергия притяжения (I и II энергетические минимумы). В II энергетическом минимуме энергия сцепления частиц недостаточна для удержания их в агрегатированном состоянии. На средних расстояниях, соответствующих толщине двойного электрического слоя, преобладает энергия отталкивания с потенциальным барьером AB, препятствующим слипанию частиц. Практика показывает, что при x = 70 мВ коллоидные системы характеризуются высоким потенциальным барьером и большой агрегативной устойчивостью. Для дестабилизации коллоидной системы, т.е. осуществления процесса коагуляции, необходимо снизить x-потенциал до значений 0 - 3 мВ.
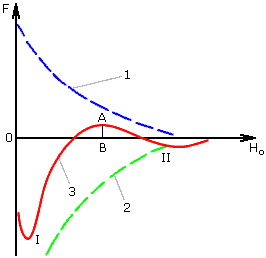
Рис. 2.2. Потенциальные кривые взаимодействия коллоидных частиц
В практике водоподготовки на электростанциях и в коммунальном водоснабжении используют один из вариантов коагуляции, связанный с вводом в природную воду реагентов, называемых коагулянтами, образующих новую дисперсную систему со знаком заряда частиц, противоположным отрицательному знаку заряда коллоидов природных вод. При этом происходит взаимная коагуляция разноименно заряженных коллоидов при их взаимодействии дестабилизированными участками поверхности, называемая гетерокоагуляцией. В дальнейшем микрохлопья сцепляются, захватывая грубодисперсные примеси и воду, и образуют коагуляционную структуру в виде хлопьев (флокул) с размером 0.5 - 3 мм (рис. 2.3). Макрофаза затем выделяется из воды в аппаратах для коагуляции - осветлителях и далее в пористой загрузке осветлительных фильтров. В качестве коагулянтов применяют сульфат алюминия Al2(SO)4 · 18H2O или сульфат двухвалентного железа FeSO4 · 7H2O, причем последний реагент используют при совмещении процессов коагуляции и известкования в осветлителях.
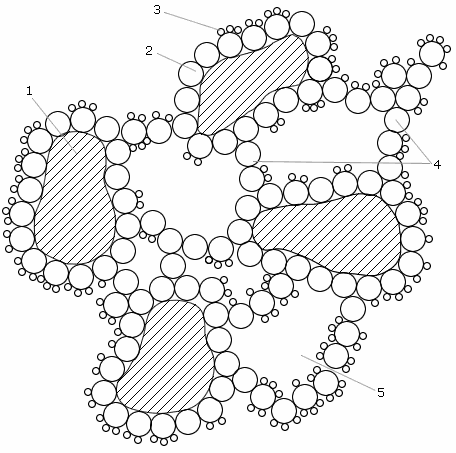
Рис. 2.3. Схема образования коагуляционных хлопьев:
1 – частицы ГДП; 2 – частицы гидроксида; 3 – органические вещества;
4 – "клеевые" мостики; 5 – полости, заполненные водой
Эти соли в воде диссоциируют:
| Al2(SO4)3 → 2Al3+ + 3SO42-, |
(2.6) |
| FeSO4 → Fe+ + SO42-. |
(2.7) |
Катионы слабых оснований Al3+ и Fe2+ легко подвергаются ступенчатому гидролизу с образованием трудно растворимых гидроксидов:
| Al3+ + 3H2O → Al(OH)3 + 3H+, |
(2.8) |
| Fe2+ + 2H2O → Fe(OH)2 + 2H+. |
(2.9) |
В щелочной среде (pH > 9,0), создаваемой при известковании, и при наличии растворенного в воде кислорода гидроксид железа (II) окисляется в менее растворимый гидроксид железа (III):
| 4Fe(OH)2 + O2 + H2O → 4Fe(OH)3. |
(2.10) |
Приведенные реакции гидролиза могут протекать до конца лишь при условии отвода ионов H+ из сферы реакции. В природной воде связывание ионов H+ происходит согласно реакции:
| H+ + HCO3 → H2CO3 → CO2 + H2O. |
(2.11) |
При щелочности обрабатываемой воды более 1.2 - 1.5 мг-экв/дм3 не возникает затруднений в отводе образующихся ионов H+, т.к. доза коагулянта (0.3 - 0.8 мг-экв/дм3) обычно меньше величины Щисх. Остаточная величина щелочности в этом случае уменьшается на значение, равное дозе коагулянта. При недостаточной величине гидрокарбонатной (бикарбонатной) щелочности концентрация ионов H+ может регулироваться введением в воду NaOH (или при известковании щелочным Ca(OH)2).
Процесс коагуляции требует для своего завершения определенного промежутка времени (4 - 5 мин). Хлопья, вначале невидимые, постепенно соединяются в крупные комплексы, вызывая помутнение воды. Затем образуются, как отмечалось, более крупные рыхлые хлопья, захватывающие грубодисперсные примеси и воду. Режим потока воды влияет на формирование хлопьев. Он может даже разрушать сформировавшиеся хлопья, поэтому скорость воды в зоне формирования и отстаивания хлопьев должна быть не более 1.5 мм/сек. К основным факторам, определяющим течение процесса коагуляции, относятся:
- Температурный режим. Подогрев коагулируемой воды до 30 - 40°С и перемешивание ее вызывает более частые и сильные столкновения коагулирующих частиц, приводящие к их слипанию;
- Дозировка коагулянта. Она определяется составом и количеством коллоидных примесей и солесодержанием обрабатываемой воды. Оптимальная доза коагулянта устанавливается опытным путем для конкретного источника водоснабжения и времени года. Обычно дозы коагулянта находятся в пределах 0.3 - 0.8 мг-экв/дм3, увеличиваясь в паводковый период до 1.0 - 1.2 мг-экв/дм3.
- Значение pH среды. Его значение оказывает влияние на скорость и полноту гидролиза коагулянта, а также на состояние удаляемых из воды примесей. При коагуляции сернокислым алюминием оптимальная величина pH, устанавливаемая также экспериментально, находится в пределах 5.5 - 7.5. При pH < 4.5 гидролиз сернокислого алюминия практически не происходит, гидроксид алюминия не образуется, а введенный в воду коагулянт остается в растворе в виде ионов Al3+ и SO42-. В щелочной среде гидроксид алюминия растворяется, диссоциируя, как кислота:
| Al(OH)3 → H+ + H2AlO3-. |
(2.12) |
При использовании FeSO4 · 7H2O величина pH определяется условиями процесса известкования.
Процесс коагуляции в ряде случаев может быть ускорен применением флокулянтов, к которым относится широко используемый синтезированный реагент - полиакриламид (ПАА).
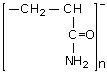
Сущность процесса флокуляции состоит в том, что ионогенные группы высокомолекулярного ПАА адсорбируют различные микрочастицы, образующиеся при коагуляции (рис. 2.4). В результате образуются крупные структурированные хлопья, легко выделяющиеся из воды. Доза ПАА обычно не превышает 0.5 - 2.0 мг/дм3. Следует подчеркнуть, что флокулация не заменяет процесс коагуляции, а лишь позволяет снизить расход коагулянта. На электростанциях ПАА применяют в периоды ухудшенного хлопьеобразования, а также при необходимости повышения нагрузки осветлителей.
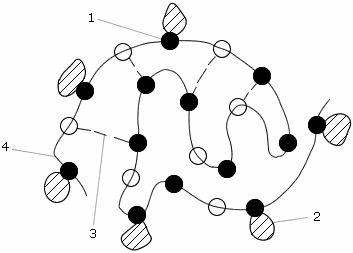
Рис. 2.4. Связывание коагуляционных микрочастиц флокулянтом
1 - адсорбирующая группа; 2 - микрочастица; 3 - внутримолекулярная связь; 4 - молекула флокулянта
Наличие сульфатов в составе типичных коагулянтов создают дополнительные трудности при необходимости их последующего удаления из воды. Гидроксиды Al(OH)3 или Fe(OH)2 могут быть получены электрохимическим способом, основанном на анодном растворении металла в воде при прохождении постоянного электрического тока. На аноде металл окисляется и его ионы переходят в раствор:
| Al - 3e → Al3+, |
(2.13) |
| Fe - 2e → Fe2+. |
(2.14) |
На катоде прием электронов осуществляется с помощью реакций восстановления. В нейтральных и щелочных растворах электроны ассимилируются на катоде молекулами воды с последующим образованием водорода и гидроксильных ионов:
| 2Н2О + 2е → Н2 + 2ОН-. |
(2.15) |
В присутствии кислорода ассимиляция электронов идет по реакции:
| 2Н2О + О2 + 4е → 4ОН-. |
(2.16) |
Ионы ОН- образуют с ионами Al3+ или Fe2+ гидроксиды. Гидроксид Fe(II) затем окисляется в гидроксид Fe(III) по реакции:
| 4Fe(OH)2 + O2 + 2Н2О → 4Fe(OH)3. |
(2.17) |
Таким образом, электрохимический метод коагуляции может быть осуществлен без введения в воду дополнительных количеств анионов SO42- и позволяет отказаться от аппаратуры, связанной с приготовлением и дозированием традиционных коагулянтов.
Электрокоагуляционный аппарат состоит из набора металлических пластин, скрепленных между собой через неэлектропроводящие шайбы, толщиной 25 мм (рис. 2.5). К пластинам подводится ток плотностью 40 - 50 А/м2 напряжением 20 - 30 В. Для уменьшения поляризации и более равномерного использования электродных пластин производят примерно через 15 мин переполюсовку подводимого напряжения.
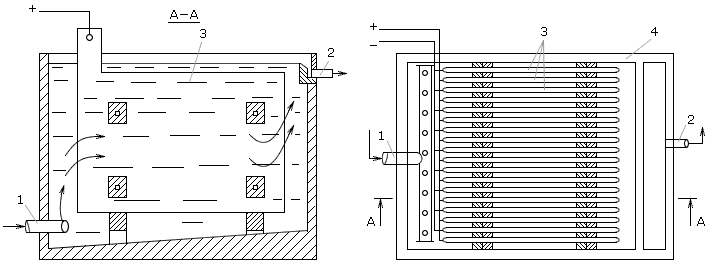
Рис. 2.5. Аппарат для анодного растворения металла при электрохимическом коагулировании:
1 - вход воды; 2 - выход воды; 3 - металлические пластины; 4 - корпус аппарата
Сокращение концентрации сульфатов, повышающейся при традиционной коагуляции, можно достичь при использовании оксихлоридов алюминия Alm(OH)nCl3m-n (ОХА), например, пентаоксихлорида алюминия Al2(OH)5Cl. По сравнению с сернокислым алюминием ОХА имеет дополнительные преимущества: в меньшей степени снижается щелочность воды, что позволяет применять его при очистке воды с низкой щелочностью без предварительного подщелачивания; эффективен в более широком диапазоне pH (от 6 до 9); существенно снижает продолжительность образования крупных хлопьев и увеличивает скорость их осаждения; в обработанной ОХА коагулированной воде содержание хлоридов устанавливается примерно в 2 - 8 раз меньше, чем сульфатов при дозировании Al2(SO4)3.
Технологические показатели качества воды после коагуляции сернокислым алюминием изменяются следующим образом:
- Общая жесткость и ее виды принимают следующие значения (мг-экв/дм3):
Жккоаг = Жкисх - Дк;
Жнккоаг = Жнкисх + Дк;
Жокоаг = Жоисх,
где Дк - доза коагулянта, мг-экв/дм3.
- Щелочность остаточная
Щосткоаг = Щоисх - Дк.
Если Щоисх меньше Дк необходимо производить подщелачивание воды перед коагуляцией добавлением NaOH в количестве
DЩ = Дк - Щоисх + Щосткоаг,
принимая значение
Щосткоаг = 0.7 мг-экв/дм3.
- Концентрация SO42- получается равной:
СSO42- = СисхSO42- + 48.03 · Дк, мг/дм3.
- Концентрация хлор-иона остается равной исходной.
- Кремнесодержание уменьшается и становится равным (0.4 - 0.5) · СSiO2.
- Окисляемость снижается на (50 - 60)% от исходной.
- Содержание ГДП после коагуляции в осветлителе обычно не превышает 5 - 10 мг/дм3, а после осветлительных фильтров - 1 мг/дм3.
Неполное снижение окисляемости и кремнесодержания при коагуляции объясняются присутствием в обрабатываемой воде не только коллоидных, но и ионных форм органических веществ и кремнесодержащих соединений.
Пример 2.1. Онлайн расчет На основе изложенных ранее положений определите показатели качества воды р. Енисей после проведения коагуляции сернокислым алюминием с дозой Дк = 0.50 мг-экв/дм3.
Качество исходной воды:
| Жо = 1.66 мг-экв/дм3 |
СНСО3 = 1.60 мг-экв/дм3 |
СSiO2 = 6.0 мг/дм3 |
| СNa = 0.47 мг-экв/дм3 |
СSO42- = 0.29 мг-экв/дм3 |
ОК = 20.0 мгО2/дм3 |
| |
СCl- = 0.24 мг-экв/дм3 |
ЖСа = 1.20 мг-экв/дм3 |
| __________________ |
__________________ |
|
| SКm = 2.13 мг-экв/дм3 |
SАн = 2.13 мг-экв/дм3 |
Жк = 1.60 мг-экв/дм3 |
| |
|
Жнк = 0.06 мг-экв/дм3 |
Находим показатели качества воды после коагуляции:
ОКкоаг = 0.4 · ОК = 0.4 · 20 = 8.0 мгО2/дм3;
CSiO2коаг = 0.5 · СSiO2 = 0.5 · 6.0 = 3.0 мг/дм3;
Жокоаг = Жо = 1.66 мг-экв/дм3;
Жккоаг = Жк - Дк = 1.60 - 0.50 = 1.10 мг-экв/дм3;
Жнккоаг = Жнк + Дк = 0.06 + 0.50 = 0.56 мг-экв/дм3;
Щокоаг = Щоисх = СНСО3 - Дк = 1.60 - 0.50 = 1.10 мг-экв/дм3;
СSO42-коаг = СSO42- + Дк = 0.29 + 0.50 = 0.79 мг-экв/дм3;
ЖСакоаг = 1.2 мг-экв/дм3
СCl-коаг = 0.24 мг-экв/дм3
СNaкоаг = 0.47 мг-экв/дм3
SКm = SАн = 2.13 мг-экв/дм3
Кроме коагуляции в осветлителях этот процесс может быть реализован по прямоточной схеме, в которой раствор реагента дозируется в трубопровод перед осветлительными фильтрами, а образовавшиеся хлопья задерживаются в верхней части фильтрующего слоя. При коагуляции на фильтрах скорость фильтрования должна быть снижена с 10 до 5 м/ч или должны применяться фильтрующие материалы с повышенной грязеемкостью, а также духслойные осветлительные фильтры.
Дозирование коагулянта должно быть точным во избежание проскока примесей через фильтры, а качество осветленной воды - аналогичным качеству воды при коагуляции в осветлителях, включая время весеннего паводка и период дождей.


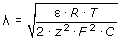 ,
,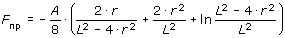 ,
,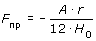 ,
,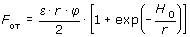 ,
,