2.3. Обработка воды реагентами-осадителями
Известкование. Известкование реализуется при обработке исходной воды в осветлителях суспензией гашеной извести Са(ОН)2, называемой известковым молоком. Основное назначение известкования - снижение щелочности обрабатываемой воды; при этом происходит частичное снижение Жо, солесодержания, кремнесодержания, концентрации соединений железа и одновременно из воды удаляются ГДП. Процесс известкования основан на том, что при вводе гашеной извести Са(ОН)2 (основания), получаемой на ВПУ при взаимодействии СаО и Н2О, достигается повышение pH обрабатываемой воды до значений 9.5 - 10.3, при котором ионы НСО3- и равновесная СО2 трансформируются в карбонат-ионы (см. рис. 1.6). С учетом присутствия в обрабатываемой воде Са2+ и образовавшихся СО32- произведение их активностей (концентраций) становится больше ПРСаСО3, поэтому из воды выделяется труднорастворимый СаСО3.
В общем, упрощенном виде процесс известкования состоит из нескольких стадий:
1) диссоциации гидрогсида кальция, приводящей к повышению pH;
| Са(ОН)2 « Са2+ + 2ОН- |
(2.18) |
2) гидратации свободной углекислоты с последующей диссоциацией по схеме:
| СО2 + Н2О + 2ОН- ® СО32- + 2Н2О; |
(2.19) |
3) диссоциации гидрокарбонатных ионов (бикарбонатов), присутствующих в воде и определяющих ее щелочность, причем в эквивалентных единицах количества образовавшихся ионов СО32- будет в 2 раза больше количества разрушаемых ионов НСО3-.
| НСО3- + ОН- ® СО32- + Н2О, |
(2.20) |
4) выделения в твердую фазу ионов Са2+ (содержащихся в исходной воде и введенных с известью) и СО32-, при достижении произведения растворимости.
| Са2+ + СО32- ® СаСО3¯, |
(2.21) |
5) при превышении дозы извести над ее количеством, необходимым для образования карбонатов в воде появляется избыток ионов ОН-и может быть превышено произведение растворимости Mg(ОН)2 с переводом Mg2+ в твердую фазу:
| Mg2+ + 2ОН- ® Mg(ОН)2¯. |
(2.22) |
При совмещении процессов известкования и коагуляции в качестве коагулянта используют обычно закисное сернокислое железо FeSO4 · 7H2O с дозой Дк (см. главу 2.2). Образование гидроксида железа при известковании происходит по суммарной реакции:
| 4FeSO4 + О2 + 2Н2О + 8ОН- ® 4Fe(OH)3 + 4SO42-. |
(2.23) |
Это вызывает дополнительное расходование извести как источника гидроксильных ионов, что должно быть учтено при расчете дозы извести. Оборудование для коагуляции осветлители целесообразно совмещать с установками для известкования поверхностных вод.
Приведенные химические реакции (2.18) - (2.23) позволяют рассчитать требуемую дозу извести в процессе известкования при выделении СаСО3 (карбонатный режим с pH около 9.5), а также увеличенную дозу извести с дополнительным осаждением Mg2+ в виде Mg(ОН)2 (гидратный режим с pH = 10.0 - 10.3). В промышленных условиях вести строгий режим дозирования извести, обеспечивающий отсутствие гидратной щелочности, практически невозможно. Поэтому обычно процесс известкования проводят в гидратном режиме с остаточной гидратной щелочностью равной 0.1 - 0.3 мг-экв/дм3, создаваемой избытком извести (ИИ). Реализации гидратного режима известкования способствуют свойства образующейся твердой фазы, имеющей однородную творожистую структуру с крупными, хорошо осаждающимися хлопьями. В отобранной пробе наблюдается четкая граница раздела между шламом и прозрачным слоем осветленной воды. При карбонатном режиме шлам имеет структуру песка, быстро оседает, но столб жидкости над границей раздела осветляется плохо. К пользе гидратного режима известкования относится также то, что присутствие гидроксида магния в осадке способствует снижению кремнесодержания на 25 - 30% за счет адсорбции ионов НSiO3- на свежеосажденном гидроксиде магния.
При необходимости снижения кремнесодержания в воде за осветлителем до 1.0 - 1.5 мг/дм3 на ряде действующих ТЭС процессы известкования и коагуляции дополняются магнезиальным обескремниванием. При дозировке каустического магнезита (смесь MgO (85%) с СаО и SiO2) в осветлитель MgO гидролизуется
| MgO + Н2О ® Mg(ОН)2. |
(2.24) |
При диссоциации по схеме
| Mg(ОН)2 ® │Mg(ОН)│+ + ОН- |
(2.25) |
поверхность твердой фазы приобретает положительный заряд и на ней происходит адсорбция анионов кремнекислоты. Расчетная доза MgO составляет около 12 мг/мг SiO32-. Из-за трудностей в обслуживании магнезитного реагентного хозяйства и развитием технологии ионитного обескремнивания в проектах ВПУ для новых ТЭС известкование с магнезитовым обескремниванием не используется.
При расчете дозы извести для конкретного типа вод необходимо учитывать их ионный состав. Для практического использования расчетная доза извести (Ди, мг-экв/дм3) определяется для большинства типов вод для которых
| Жобщ + Дк ³ Щисх - Щoбр |
(2.26) |
как
| Ди = ССО2исх + Щисх + ЖMg + Дк + Ии |
(2.27) |
принимая в первом приближении при оценочных расчетах Щoбр = 0. Конкретизация значения Ди проводится обычно при наладке работы осветлителя. Передозировка извести по отношению к доле выделенного Mg2+ при гидратном режиме известкования не сопровождается снижением жесткости и щелочности, а вызовет замену некарбонатной жесткости на кальциевую по реакции:
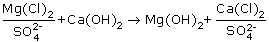 , , |
(2.28) |
К моменту прохождения всех стадий процесса известкования остаточная величина карбонатной щелочности (т.е. суммы СО32- и НСО3-) обычно составляет 0.5 - 0.8 мг-экв/дм3 в зависимости от величины ЖСа известкованной воды (табл. 2.2).
Таблица 2.2
Зависимость щелочности известкованной воды от остаточной концентрации иона кальция
| Щелочность |
Концентрация ионов Саизв2+, мг-экв/дм3 |
| 0.5 - 1 |
1 - 3 |
более 3 |
| Гидратная |
0.05 - 0.20 |
0.05 - 0.20 |
0.05 - 0.20 |
| Карбонатная (СО32- + НСО3-) |
0.7 - 0.8 |
0.6 - 0.7 |
0.5 - 0.6 |
| Общая |
0.75 - 1.0 |
0.65 - 0.90 |
0.55 - 0.80 |
Данные, приведенные в табл. 2.2, получены для работы осветлителей в производственных условиях. Они превышают равновесные (расчетные) концентрации для карбонатной щелочности на 0.2 - 0.4 мг-экв/дм3 (рис. 2.6).
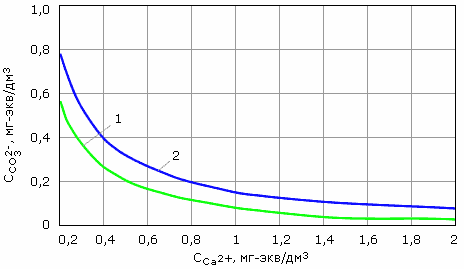
Рис. 2.6. Зависимость остаточных равновесных концентраций ионов СО32- и Са2+ в известкованной при 50°С:
1, 2 – солесодержание воды 1.1 и 5.8 мг-экв/дм3
Определение составляющих общей щелочности (СОН-, ССО32-, СНСО3-) при рН > 9.5, важное для последующих расчетов схем ВПУ, может быть реализовано путем совместного решения системы уравнений, включающей уравнение первой и второй ступеней диссоциации угольной кислоты, уравнение ионного произведения воды и уравнение электронейтральности раствора, содержащего углекислые соединения. На рис. 2.7 такое решение приведено в виде номограммы, составленной для температуры 25°С и общего солесодержания 20 мг/дм3, облегчающее определение компонентов щелочности воды по общей щелочности и рН. В качестве примера на номограмме показано, что при Щo = 0.8 мг-экв/дм3 и рН = 10.2 найденные значения компонентов составляют: ССО32- = 0.40, СНСО3- = 0.24 и СОН- = 0.16 мг-экв/дм3.
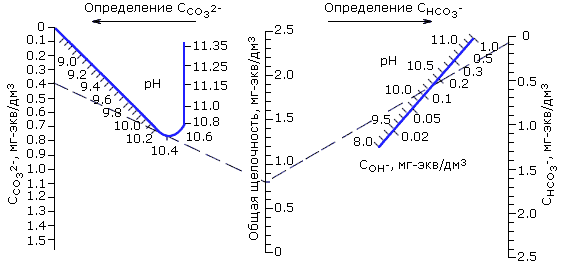
Рис. 2.7. Номограмма для определения компонентов общей щелочности воды
Онлайн расчет
При большом солесодержании воды, например, при известковании природных вод, к величинам, найденным по номограмме, должны быть введены поправочные коэффициенты-множители: g - для СНСО3-, d - для ССО32- и h - для СОН-, значения которых определяются по данным табл. 2.3 и табл. 2.4.
Таблица 2.3
Поправочные коэффициенты g и d
| рН |
Общее солесодержание в мг/дм3 |
| 50 |
100 |
200 |
300 |
400 |
500 |
| g |
d |
g |
d |
g |
d |
g |
d |
g |
d |
g |
d |
| 8 |
1.0 |
1.04 |
1.0 |
1.11 |
1.0 |
1.20 |
1.0 |
1.28 |
1.0 |
1.34 |
1.0 |
1.39 |
| 9 |
0.99 |
1.04 |
0.99 |
1.09 |
0.98 |
1.18 |
0.97 |
1.24 |
0.97 |
1.30 |
0.96 |
1.34 |
| 10 |
0.98 |
1.02 |
0.95 |
1.05 |
0.90 |
1.09 |
0.87 |
1.12 |
0.85 |
1.14 |
0.83 |
1.16 |
| 11 |
0.96 |
1.0 |
0.91 |
1.0 |
0.84 |
1.01 |
0.80 |
1.02 |
0.76 |
1.02 |
0.73 |
1.02 |
Таблица 2.4
Поправочный коэффициент h
| Общее солесодержание в мг/дм3 |
50 |
100 |
200 |
300 |
400 |
500 |
600 |
800 |
1000 |
| h |
1.03 |
1.06 |
1.10 |
1.13 |
1.16 |
1.19 |
1.22 |
1.28 |
1.34 |
Теоретические равновесные концентрации примесей в известкованной воде рассчитываются с учетом показателей качества исходной воды, расчетных параметров процессов известкования и коагуляции (Ди, Дк, Ии, pH, t), коэффициентов активности ионов различной валентности, табличных значений ПРСаСО3, ПРMg(ОН)2, КН2О, К1Н2СО3, К2Н2СО3 и уравнения электронейтральности путем решения с использованием ПЭВМ системы из десятка уравнений. Методика и примеры подобных расчетов приведены в главе 10. Необходимые для расчетов значения констант в интервале температур 25 - 40°С сведены в табл. 2.5.
Таблица 2.5
Значения термодинамических констант
| Константа |
Температура, °С |
| 25 |
30 |
35 |
40 |
| КН2О · 1014 |
1.01 |
1.47 |
2.09 |
2.92 |
| К1Н2СО3 · 107 |
4.45 |
4.71 |
4.90 |
5.04 |
| К2Н2СО3 · 1011 |
4.69 |
5.13 |
5.62 |
6.03 |
| ПРСаСО3 · 109 |
4.46 |
4.00 |
3.55 |
3.00 |
| ПРMg(ОН)2 · 1011 |
0.80 |
0.72 |
0.66 |
0.60 |
Ухудшение реальных результатов по щелочности, концентрациям ионов Са2+ (на 0.15 - 0.30 мг-экв/дм3) и Mg2+ (на 0.1 - 0.15 мг-экв/дм3) в процессе известкования по сравнению с равновесными их значениями связывают с влиянием кинетических факторов: достаточно медленной кристаллизации образующейся твердой фазы СаСО3 и Mg(ОН)2 при приближении системы к состоянию равновесия и "тормозящей" роли органических примесей (защитных коллоидов) исходной воды, а также выносом из осветлителя микрокристаллов твердой фазы.
В эксплуатационных условиях результаты известкования обычно оцениваются по следующим показателям: остаточная щелочность, стабильность, содержание взвешенных веществ, окисляемость, жесткость, содержание железа, сухой остаток.
Остаточная щелочность составляет примерно 0.5 - 0.8 мг-экв/дм3, причем меньшие значения отвечают большей остаточной жесткости (3 - 5 мг-экв/дм3) и меньшей минерализации исходной воды, а большие - соответственно меньшим значениям Жоост. С увеличением солесодержания в соответствии с ростом равновесных концентраций и снижением скорости кристаллизации остаточная щелочности может достигать 1.0 - 1.5 мг-экв/дм3. Повышение значения остаточной щелочности наблюдается также и при известковании воды с высоким содержанием органических примесей, особенно примесей техногенного происхождения.
Стабильность - одно из важнейших и обязательных требований к известкованной воде. Чем ближе вода, представляющая собой в процессе обработки пресыщенный раствор, к состоянию равновесия, тем она стабильнее и тем меньше ее склонность к образованию впоследствии отложений на трубопроводах и на зернах фильтрующего материала осветлительных фильтров. Степень отклонения от стабильности на практике характеризуют так называемой нестабильностью, т.е. возможным последующим снижением щелочности и жесткости известкованной воды. На практике нестабильность определяют по разности щелочности воды на выходе из осветлителя и щелочности фильтрата осветлительных фильтров, установленных после осветлителя.
Содержание взвешенных веществ при налаженном режиме работы осветлителя обычно составляет Свзв = 2 - 5 мг/дм3 при норме не более 10 мг/дм3. Вследствие трудоемкости процесса определения содержания взвешенных веществ этот показатель используют в качестве контрольного. Для оперативной оценки устойчивости работы осветлителя содержание взвешенных веществ заменяют на косвенный показатель - прозрачность. Прозрачность обычно определяют по шрифту или кольцу. При устойчивой работе осветлителя (Свзв < 5 мг/дм3) прозрачность составляет не менее 30 см.
Перманганатная окисляемость известкованной воды снижается до 3 - 4 мгО2/дм3, если исходная вода содержит только природные примеси. При загрязнении природной воды промышленными стоками степень удаления органических примесей колеблется в широких пределах и составляет обычно 30 - 50%, а окисляемость известкованной воды может достигать 7 - 10 мгO2/дм3. Следует помнить об условности перманганатной окисляемости, которая в наибольшей мере сказывается при загрязнении воды органическими примесями техногенного происхождения.
Жесткость известкованной воды зависит от ее остаточной щелочности, дозы коагулянта и некарбонатной жесткости исходной воды:
| Жоост = Жоисх - Щoисх + Щoост + Дк, мг-экв/дм3 |
(2.29) |
Снижение содержания кремнекислых соединений при известковании зависит от количества выделяемого гидроксида магния. Обычно остаточная концентрация SiO2 составляет 40 - 60% исходной, но, как правило, не меньше 2 - 5 мг/дм3.
Остаточное содержание железа обычно определяется в основном кинетикой кристаллизации труднорастворимых гидроксидов Fe(OH)2 и Fe(OH)3 и присутствием в воде их коллоидно-дисперсных форм, включая органические комплексные соединения. Если концентрация Fe2+ в исходной воде значительна, доза извести должна быть увеличена на исходную концентрацию железа. Обычно остаточная концентрация железа в известкованной и коагулированной воде составляет 50 - 150 мкг/дм3.
Пример 2.2. Онлайн расчет На основе изложенных ранее положений определите показатели качества р. Волга после проведения процессов известкования и коагуляции при pH = 10.2 в осветлителе с дозой коагулянта FeSO4 Дк = 0.4 мг-экв/дм3, избытком извести Ии = 0.20 мг-экв/дм3, рассчитайте значение дозы извести при содержании свободной углекислоты в исходной воде ССО2 = 0.16 мг-экв/дм3 и остаточной карбонатной щелочности известкованной воды Щкизв = 0.6 мг-экв/дм3.
1. Качество исходной воды:
| Жо = 3.8 мг-экв/дм3 |
Щo = 3.0 мг-экв/дм3 |
СSiO2 = 9.0 мг/дм3 |
| СNa+ = 1.0 мг-экв/дм3 |
СSO42- = 1.4 мг-экв/дм3 |
ОК = 10.0 мгО2/дм3 |
| __________________ |
|
|
| SКm = 4.8 мг-экв/дм3 |
СCl- = 0.4 мг-экв/дм3 |
СГДП = 30 мг/дм3 |
| |
__________________ |
|
| |
SАн = 4.8 мг-экв/дм3 |
ЖСа = 3.0 мг-экв/дм3 |
| |
|
Жк = 3.0 мг-экв/дм3 |
| |
|
Жнк = 0.8 мг-экв/дм3 |
2. Расчетное определение технологических показателей и качества известково-коагулированной воды:
2.1. Определяем соотношение
Жо + Дк и Щисх - Щoбр;
3.8 + 0.4 > 3.0 - 0.5;
2.2. Ди = ССО2исх + Щoисх + ЖMgисх + Дк + Ии; ЖMg = Жо - ЖСа = 3.8 - 3.0 = 0.8 мг-экв/дм3;
Следовательно,
Ди = 0.16 + 3.0 + 0.8 + 0.4 + 0.2 = 4,56 мг-экв/дм3;
2.3. Жкизв = Щкизв = 0.6 мг-экв/дм3;
2.4. Жнкизв = Жнк + Дк = 0.8 + 0.4 = 1.2 мг-экв/дм3;
2.5. Жоизв = Жкизв + Жнкизв = 0.76 + 1.2 = 1.96 мг-экв/дм3;
2.6. СSO42-изв = СSO42- + Дк = 1.4 + 0.4 = 1.8 мг-экв/дм3;
2.7. СSiO2изв = 0.5 · СSiO2 = 0.5 · 9.0 = 4.5 мг/дм3;
2.8. OКизв = 0.4 · ОК = 0.4 · 10.0 = 4.0 мгО2/дм3;
2.9. СCl-изв = СCl- = 0.4 мг-экв/дм3, СNaизв = СNa =1.0 мг-экв/дм3;
2.10. СOH- = 0.16 мг-экв/дм3
2.11. СГДПизв ≤ 10 мг/дм3.
2.12. SКm = SАн = 2.96 мг-экв/дм3
Содоизвесткование. При известковании воды, как отмечалось, ЖСа снижается на величину (Щo - Щкизв) за счет образования труднорастворимого СаСО3, одновременно часть ЖMg выделяется за счет образования труднорастворимого Mg(ОН)2. Значение Жоизв (см. пример 2.2) характеризуется недостаточно высоким эффектом осаждения. Для повышения эффекта осаждения ионов Са2+ и Mg2+ технология известкования дополняется обработкой воды кальцинированной содой Nа2СО3. При содоизвестковании ионы магния при замене его в некарбонатной жесткости на кальций по реакции (2.28) удаляются практически полностью, а кальциевые соли некарбонатной жесткости осаждаются содой:
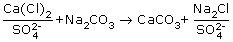 , , |
(2.30) |
Расчетная (теоретическая) остаточная общая жесткость содоизвесткованной воды (мг-экв/дм3) определяется уравнением:
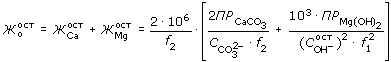 , , |
(2.31) |
Остаточная общая щелочность содоизвесткованной воды
| Щoост = ССО3-ост + СОН-ост. |
(2.32) |
Из (2.31) следует, что для получения минимальных остаточных концентраций ионов Са2+ и Mg2+, необходимы повышенные остаточные концентрации ионов СО32- и извести. Доза извести рассчитывается по (2.27) при одновременной подаче коагулянта, а соды по формуле:
| Дc = Жисх - Щисх + Дк + Ии + Иc, |
(2.33) |
где Иc - избыток соды. Величины фактически потребной дозы соды уточняют по желаемой величине ЖоСТ. В настоящее время метод содоизвесткования используют в малосточных схемах умягчения на предочистке с последующим катионированием, а также для восстановления и повторного использования сточных вод катионитных фильтров.
MathCad-документы, по которым можно рассчитать равновесные и реальные концентрации ионов в воде после известкования и коагуляции, хранятся на сайте www.vpu.ru в файлах с именами Calc_IK_Ravnov_Posl_Pribl.mcd, Calc_IK_Ravnov_Progr.mcd и Calc_IK_Real.mcd
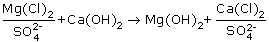 ,
,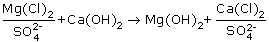 ,
,

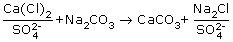 ,
,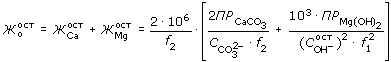 ,
,