4.1. Общие сведения об ионитах и закономерностях ионообменных процессов
Рассмотрев положения, определяющие технологию удаления из природных вод и конденсатов грубодисперсных и коллоидных примесей, отметим, что предварительная очистка воды недостаточна при подготовке воды, потребляемой в качестве добавочной для котлов и подпиточной для тепловых сетей. Заключительная стадия подготовки воды, связанная с изменением ее ионного состава, вплоть до полного удаления растворенных примесей, реализуется с помощью ионообменной технологии, а также мембранными или термическими методами.
Сущность ионного обмена заключается в способности специальных материалов (ионитов) изменять в желаемом направлении ионный состав обрабатываемой воды. Иониты представляют собой нерастворимые высокомолекулярные вещества, которые благодаря наличию в них специальных функциональных групп способны к реакциям ионного обмена. Другими словами, иониты способны поглощать из раствора положительные или отрицательные ионы в обмен на эквивалентные количества других ионов, содержащихся в ионите, имеющих заряд того же знака. По знаку заряда обменивающихся ионов различают катиониты и аниониты. Способность ионитов к обмену ионами с раствором определяется их строением. Иониты состоят из нерастворимой твердой основы (матрицы), получаемой чаще всего путем сополимеризации исходных продуктов: стирола ( - CH = CH2) и дивинилбензола (CH2 - CH -
- CH = CH2) и дивинилбензола (CH2 - CH -  - CH - CH2), добавляемого в количестве около 8% для поперечной сшивки линейного полистирола. Полученная в форме зерен пространственная сетка углеводородных цепей - матрица (рис. 4.1) при помещении ее в воду способна увеличивать свой объем в 1.1 - 2.0 раза за счет взаимодействия с полярными молекулами H2O, что дает возможность взаимной диффузии обменивающихся ионов после завершения синтеза и превращения матрицы в ионит.
- CH - CH2), добавляемого в количестве около 8% для поперечной сшивки линейного полистирола. Полученная в форме зерен пространственная сетка углеводородных цепей - матрица (рис. 4.1) при помещении ее в воду способна увеличивать свой объем в 1.1 - 2.0 раза за счет взаимодействия с полярными молекулами H2O, что дает возможность взаимной диффузии обменивающихся ионов после завершения синтеза и превращения матрицы в ионит.

Рис. 4.1. Зерна сополимера - матрицы ионитов
Некоторые типы ионитов получают методом поликонденсации, например, анионит марки АН-31. В процессе поликонденсации ионит получается вначале в форме монолита, который затем измельчают механически, в результате чего зерна такого ионита имеют неправильную форму, пронизаны микротрещинами и имеют меньшую механическую прочность.
Полученную матрицу обрабатывают химическими реагентами, прививая к ней специальные функциональные группы, замещающие в бензольных кольцах ионы водорода и которые способны к диссоциации в растворах (рис. 4.2). Фиксированный на матрице ион (часть функциональной группы) определяет возникновение заряда и носит название потенциалообразующего. Заряд каркаса компенсируется зарядом ионов противоположного знака, называемых противоионами (рис. 4.3). Противоионы образуют диффузный слой, они подвижны вокруг матрицы и могут быть заменены другими ионами с зарядом того же знака. Появление потенциалообразующих - и противоионов может происходить не только за счет диссоциации функциональных групп (например, -SO3H ® -SO3- + H+), но и за счет адсорбции функциональными группами из раствора ионов какого-либо знака заряда (например, -NH2 + H+ ® -NH3+). Обычно матрицу с фиксированными ионамиобозначают символом R, а противоион - химическим символом, например, RNa - катионит с обменным ионом (противоином) натрия, а ROH - анионит с обменной гидроксильной группой. С использованием таких символов типичная реакция катионного обмена записывается как:
| 2RNa + Са2+ + 2Cl- « R2Ca + 2Na+ + 2Cl-. |
(4.1) |

Рис. 4.2. Структура матрицы ионита с привитыми функциональными
сульфогруппами на бензольные кольца

Рис. 4.3. Структура элемента объема ионитов:
а – катионит; б – анионит; 1 – матрица; 2 – потенциалообразующие фиксированные ионы; 3 – ионы диффузного слоя
Реакция (4.1) осуществляется, например, при умягчении воды с помощью катионита в исходной натриевой форме. Катионит поглощает из раствора ионы-накипеобразователи кальция в обмен на ионы Na+.
Аналогично можно записать реакцию обмена анионами на анионите, например:
| ROH + Na+ + Cl- « RCl + Na+ + OH-. |
(4.2) |
Учитывая изложенное, ионит можно представить как твердый электролит, неподвижный каркас которого представляет одну его часть, а подвижные противоионы - другую. Следовательно, реакция ионного обмена подчиняется правилам, действующим для реакций обычных электролитов, а именно, правилам эквивалентности обмена ионов и обратимости этого процесса. Кроме того, в ионообменной технологии большую роль играет способность к преимущественной адсорбции одних ионов по сравнению с другими, получившая название селективности (избирательности) и скорость установления ионообменного равновесия (кинетика ионного обмена).
Эквивалентность обмена ионов состоит в том, что понижение концентрации какого-либо иона в растворе в результате его удержания ионитом сопровождается эквивалентным повышением концентрации другого иона, поступающего в раствор из ионита, что является следствием закона электронейтральности. Использование этой закономерности позволяет рассчитывать массовые концентрации примесей в системе "ионит - раствор".
Обратимость процессов обмена ионов позволяет многократно использовать дорогостоящие иониты в технологии обработки воды, что можно показать на примере катионообменной реакции (4.1).
После замены катионов Na+ в катионите ионами Ca2+ (прямая реакция) обычно осуществляют обратный процесс - регенерацию, приводящую к восстановлению способности катионита извлекать из обрабатываемой воды ионы Ca2+.
При обработке многокомпонентного раствора, каким является природная вода, большое значение имеет преимущественная адсорбция ионитами одних ионов по сравнению с другими. Причиной, вызывающей селективность ионного обмена, является различие энергий притяжения различных ионов твердой фазой, обусловленной величинами радиуса адсорбируемых ионов и их зарядов. Последнее вытекает из закона Кулона, если принять, что адсорбируемый ион непосредственно взаимодействует с противоположно заряженными потенциалообразующими ионами, фиксированными на матрице. С уменьшением радиуса должна возрастать энергия притяжения, но при этом необходимо учитывать, что ионы, взаимодействующие с ионитами, находятся в растворе в гидратированном состоянии, т.е. окружены прочно связанной с ними оболочкой из дипольных молекул воды, диаметр которых равен 0.276 нм.
Известно, что в пределах каждой основной подгруппы периодической системы элементов радиусы ионов возрастают с увеличением атомной массы элемента. С изменением радиуса ионов изменяется и степень их гидратации, уменьшаясь с его возрастанием, что можно, например, видеть в табл. 4.1.
Таблица 4.1
Радиусы и гидратация ионов щелочноземельных металлов
| Показатель |
Ионы |
| Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
| Радиус иона, 1010 м |
0.78 |
1.06 |
1.27 |
1.43 |
| Число молекул H2O, гидратирующих ион (по Реми) |
14 |
10 - 12 |
8 |
4 |
Из таблицы следует, что минимальный радиус в гидратированном состоянии имеет ион Ba2+. Фактически наблюдаемая селективность ионообменной адсорбции этих ионов полностью отвечает вытекающему из этого соотношения радиусов (наибольшая селективность адсорбции у ионов Ba2+, наименьшая из щелочноземельных металлов у иона Mg2+).
При увеличении заряда иона (т.е. при повышении его валентности) увеличивается энергия притяжения его по закону Кулона противоположно заряженной твердой фазой. Поэтому с повышением валентности ионов селективность адсорбции их ионитами возрастает. Соответственно этому двухвалентные ионы адсорбируются преимущественно перед одновалентными, трехвалентные - преимущественно пред двухвалентными.
Ряды селективности (преимущественной адсорбции на ионитах) наиболее важных в практике водоподготовки ионов имеют следующий вид:
Li+ < Na+ < K+ » NH4+ < Cs+ < Mn2+ < Mg2+ < Zn2+ < Ca2+ < Sr2+ < Ba2+ < Al3+.
Для сильнодиссоциирующих катионитов ион H+ помещается между Li+ и Na+, смещаясь в глубину ряда для слабокислотных катионитов.
Основные катионы природных вод могут быть вычленены в следующий ряд селективности:
Na+ < Mg2+ < Ca2+.
Анионы при обмене на сильно диссоциирующих анионитах:
F- < OH- < Cl- < H2PO4- < NO3- < I- < SO42-.
Основные анионы природных вод характеризуются следующим рядом селективности:
HSiO3- < HCO3- < Cl- < SO42-,
т.е. анионы слабых кислот сорбируются анионитами слабее, чем анионы сильных кислот.
Количественно селективность может быть выражена через коэффициент селективности TA/B:
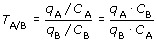 , , |
(4.3) |
где q и C - эквивалентные концентрации обменивающихся ионов A и B в ионите и в растворе.
Коэффициент селективности зависит от свойств ионитов, концентрации и природы адсорбируемых ионов, температуры. Его обычно определяют на основании экспериментальных кривых изотерм адсорбции, по оси абсцисс которых откладывают относительную концентрацию ионов A и B в растворе (C1), по оси ординат относительное содержание этих ионов в ионите. Например, для какой-то точки M (рис. 4.4) кривой изотермы адсорбции абсцисса BM соответствует CA, абсцисса MN - CB, ордината MD - qA, ордината EM - qB. Исходя из (4.3), коэффициент селективности TA/B равен отношению площади прямоугольника MCKD к площади прямоугольника FEMB.
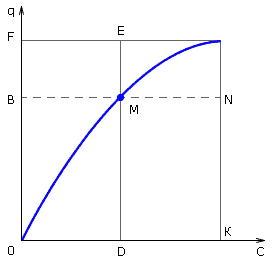
Рис. 4.4. Графическое определение коэффициента селективности по кривой изотермы адсорбции
Анимация - Изотерма адсорбции выпуклая
Анимация - Изотерма адсорбции выпуклая
Уравнение (4.3) применимо только к равновесному состоянию системы ионит - раствор. В производственных условиях, когда раствор фильтруется через слой ионита, равновесия не достигают из-за влияния кинетических факторов, т.е. скорости ионного обмена. Понятия, связанные со скоростью обменных процессов, можно проиллюстрировать с помощью рис. 4.5, на котором показана схема взаимодиффузии на зерне ионита в H-форме при обмене в динамических условиях с ионами натрия. Зерно RH окружает статический слой раствора, известный как пленка Нернста толщиной от 10-2 до 10-3 см, в котором перемещение ионов происходит только за счет диффузии. Диффузия сквозь пленку и в зерне ионита происходит при разных скоростях, поэтому определить скорость обмена могут эти два процесса:
1) диффузия ионов внутри зерна;
2) диффузия в пленке.
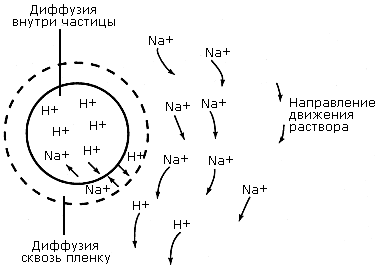
Рис. 4.5. Схема диффузии ионов сквозь пленку и внутри зерна
Более медленный процесс контролирует общую скорость ионного обмена. При высоких концентрациях ионов в растворе (более 0.2 н) лимитирующей является внутридиффузионная кинетика, при обработке природных вод с солесодержанием менее 1 г/дм3, т.е. при низком градиенте концентраций в неподвижной пленке Нернста, скорость ионного обмена определяется внешенедиффузионной кинетикой. Скорость ионного обмена (скорость истощения) при исчерпании 50% обменной емкости обычно составляет несколько десятков секунд.
При пропуске обрабатываемого раствора, содержащего ионы B, через ионит, первоначально насыщенный ионами A (рис. 4.6), протекая, раствор будет постоянно контактировать с новыми слоями свежего (неиспользованного) ионита. Со временем, верхние слои ионита отдадут все ионы A и потеряют свою ионообменную способность, они как бы истощатся (зона a). Вследствие этого переходная зона, в которой происходит ионный обмен (зона b), будет все дальше и дальше перемещаться вниз по слою. При определенных условиях эта зона достигает стационарной ширины. Распределение концентраций обменивающихся ионов в этой зоне носит название фронта фильтрования. В нижних слоях (зона c) ионит еще полностью насыщен ионами A. Когда нижняя граница переходной зоны достигнет конца слоя ионита, наступит проскок иона B в фильтрат, что служит обычно сигналом для отключения фильтра на регенерацию.

Рис. 4.6. Схема ионообменного процесса в ионитном фильтре
В зависимости от коэффициента селективности обменивающихся ионов фронт фильтрования может сформироваться острым и переноситься параллельно или размытым (диффузным), расширяющимся при движении по высоте слоя ионита. Кривая, показывающая зависимость концентрации примесей в фильтрате от времени работы фильтра (или объема пропущенного через фильтр раствора), носит название выходной кривой. Примеры выходных кривых при остром и диффузном фронтах фильтрования приведены на рис. 4.7. От вида кривой фронта фильтрования зависит степень использования обменной емкости при работе фильтра, поэтому при обосновании ионообменной технологии иониты подбирают так, чтобы сорбция наиболее важных ионов в водоподготовке происходила при остром фронте фильтрования.
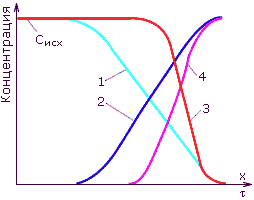
Рис. 4.7. Фронты фильтрования и выходные кривые в ионитных фильтрах:
1 – диффузный слой фильтрования; 2 – выходная кривая при диффузном фронте; 3 – острый фронт фильтрования; 4 – выходная кривая при остром фронте; x – высота слоя ионита; t - время работы фильтра
На формирование фронта фильтрования влияют так же гидродинамические процессы, определяемые скоростью фильтрования, структурой зернистого слоя, конструкцией дренажных устройств и рядом других факторов. На сайте www.vpu.ru в Mathcad-документе с именем Front_Ionit.mcd строятся кривые фронтов фильтрования и выходные кривые для различных изотерм адсорбции.
 - CH = CH2)
- CH = CH2) - CH - CH2),
- CH - CH2), - CH = CH2)
- CH = CH2) - CH - CH2),
- CH - CH2),


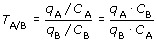 ,
,


