6.1. Общие положения
Вода, используемая на ТЭС, содержит различные растворенные газы, находящиеся в природной воде в виде примесей (см. гл. 1), образующиеся в результате процессов водоподготовки (см. гл. 2 и гл. 4) или термического воздействия, а также поступающие в вакуумную часть циклов ТЭС с присосами воздуха.
Растворенные в водных носителях газы можно подразделить на химически взаимодействующие с водой (CO2, NH3, Cl2) и не взаимодействующие (N2, O2, H2). Эти же газы разделяются также на коррозионно-активные (O2, CO2, Cl2) и инертные (N2, H2). Основной целью удаления из теплоносителя растворенных в нем газов является предотвращение коррозии оборудования.
Кислород (O2), азот (N2) и диоксид углерода (CO2) попадают в воду вследствие контакта ее с воздухом. Кроме того, высокие концентрации CO2 возникают в воде в результате ее обработки H-катионированием или путем подкисления. Водород обычно является продуктом коррозии металла оборудования. Все известные способы удаления из воды растворенных газов основаны на двух принципах: десорбция газов из воды; химическое связывание газов с превращением их в иные, безвредные вещества. В ряде случаев в различные потоки воды на ТЭС специально вводят газовые примеси, служащие коррекционными добавками. Например, аммиак NH3, находящийся в водных растворах в форме ионов NH4+, вводится в питательную воду при ее аминировании, газообразный хлор используется при обработке охлаждающей воды и т.д.
Процессы выделения газов из воды (десорбция) и растворения газов в воде (абсорбция) подчиняются общим законам массопередачи в системе жидкость - газ и протекают до тех пор, пока не будет достигнуто равновесия, зависящее от температуры, давления и концентраций в обеих фазах. В условиях равновесия процессы десорбции и абсорбции подчиняются закону Генри, который утверждает, что при данной температуре концентрация растворенного газа в жидкости пропорциональна давлению этого газа над жидкостью :
где Cг - концентрация газа в воде, моль/дм3; Pг - давление данного газа над водой, Па; kг - коэффициент абсорбции (величина обратная константе Генри). Коэффициент абсорбции характеризует объем газа, растворяющегося при стандартных условиях в единице объема раствора, его значения приводятся в справочной литературе.
Из уравнения (6.1) следует, что для осуществления массообмена между водой и газом, парциальное давление в газовой фазе должно либо уменьшаться, либо увеличиваться в зависимости от требуемого направления массообмена. Если газ взаимодействует с водой (CO2, NH3), то физически растворенная часть газа должна быть связана как с законом Генри, так и с той частью газа, которая образует ионные формы согласно закону действующих масс.
На практике обычно вода находится в контакте не с одним каким-либо газом, а со смесью газов, например, с воздухом. Парциальное давление газа в смеси определяется законом Дальтона, который гласит, что полное давление газовой смеси P0 равно сумме парциальных давлений составляющих смесь газов P1, P2, P3 и т.д., то есть каждый газ в смеси ведет себя так, как если бы он один заполнял весь объем:
| Р0 = Р1 + Р2 + Р3 + ... + Рn |
(6.2) |
Из формул (6.1), (6.2) видно, что полное удаление газов (Cг = 0) можно достичь при Pг = 0 или, что то же самое, при P0 = 0 или P0 = PH2O. Это достигается созданием над поверхностью воды вакуума, либо атмосферы, не содержащей удаляемого газа, в частности путем нагрева воды до кипения, когда парциальное давление паров воды становится равным общему давлению (P0 = PH2O), что равносильно снижению парциального давления удаляемого газа до нуля.
Как отмечалось, содержание газа в воздухе соответствует закону Генри лишь в равновесных условиях, поэтому из законов Генри и Рауля нельзя определить скорость удаления газов (кинетику процесса). Между тем от скорости десорбции зависит конечный эффект дегазации, т.е. степень приближения системы к равновесному состоянию. В общем виде скорость десорбции газа определяется уравнением:
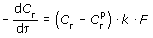 , , |
(6.3) |
где Cг - концентрация газа в воде в данный момент времени; Cгр - равновесная концентрация газа в воде, соответствующая парциальному давлению этого газа над водой; F - удельная поверхность раздела фаз, k - коэффициент пропорциональности.
Подставив в это уравнение Cгр = 0 (Pг = 0), разделив переменные и проинтегрировав для концентрации газа в пределах от Cг до 0, а для времени - от 0 до T, получим:
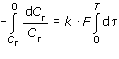 , , |
(6.4) |
| ln(Cг / 0) = k · F · T |
| или k · F · T = ¥ |
Так как k · F - величина конечная и положительная, то только T может равняться бесконечности, поэтому получить Cг = 0 невозможно за конечный промежуток времени даже при условии, что Pг = 0. Конечную концентрацию Cк газа можно получить из уравнения (6.4), приняв определенное значение поверхности раздела фаз и времени tк:
| ln(C1/Cк) = k · F · tк |
(6.5) |
| |
| или Ск = Сг · е-k · F · tк |
Эффект дегазации можно повысить в соответствии с (6.5) увеличением удельной поверхности раздела фаз, что приводит к сокращению путей диффузии удаляемого газа из капли или пленки жидкости, а при прочих равных условиях увеличивает время контакта воды с газовой фазой, свободной от удаляемого из воды газа. На эффективность дегазации также существенно влияет повышение температуры очищаемой газосодержащей воды. Это обусловлено тем, что с повышением температуры уменьшается коэффициент абсорбции газа водой, что можно видеть на рис. 6.1.
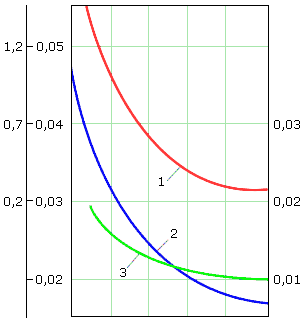
Рис. 6.1. Зависимость коэффициентов абсорбции CO2 (1), N2 (2) и O2 (3) водой от температуры
Количество удаляемого в десорбере газа G, кг/ч, может быть подсчитано по уравнению:
| G = Q · (Cн - Ск) = kм · F · DCср |
(6.6) |
где Q - расход воды, м3/ч; Cн, Cк - начальная и конечная концентрация газа в воде, кг/м3; kм - коэффициент массопередачи, м/ч; F - поверхность раздела фаз, м2; DCср - средняя движущая сила процесса десорбции, кг/м3.
Рассмотренные закономерности десорбционного метода удаления газов положены в основу конструирования и приемов эксплуатации декарбонизаторов, термических и вакуумных деаэраторов.
Химическое связывание газов с превращением их в безвредные соединения реализуются путем дозирования в воду специальных химических реагентов. Чаще всего для этой цели применяются различные восстановители (для связывания кислорода) или основания (для связывания CO2).
Эффективность таких методов дегазации определяется законами химической кинетики, а полнота связывания растворенных газов зависит от природы и избытка добавляемого реагента, температуры, состава примесей обрабатываемой воды и продолжительности взаимодействия газа и реагента.
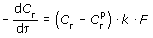 ,
,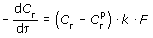 ,
,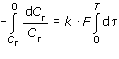 ,
,