Природная вода, разделяемая условно на атмосферную (дождь, туман, снег), поверхностную (реки, озера, пруды, болота), подземную (артезианские скважины, шахтные колодцы) и морскую (моря, океаны), всегда содержит различные примеси. Характер и количество имеющихся в воде примесей определяют качество воды, т. е. характеризуют возможность использования ее для различных целей в промышленности и в быту. Примеси поступают в воду, находящуюся в природном круговороте, из окружающей ее среды. Вода, занимающая около 70% поверхности Земли, испаряясь, поступает в атмосферу, а после конденсации водяных паров в верхних слоях атмосферы возвращается на поверхность Земли в виде осадков, образуя поверхностные и подземные стоки и водоемы. Подземные стоки создаются при просачивании атмосферной воды в более или менее глубокие слои почвы, где вода собирается над водонепроницаемыми пластами, стекает по ним и выходит вновь на поверхность земли, в местах выхода этих пластов, сливаясь с поверхностными стоками. Далее вода в руслах рек и ручьев перемещается к озерам, морям, водохранилищам, завершая этим свой природный круговорот. Наряду с природным существует производственно - бытовой круговорот воды, создаваемый в результате потребления ее для различных целей (охлаждение, коммунальное водоснабжение и т. п.).
Примеси поступают в воду на всех этапах отмеченных круговоротов. При конденсации влаги в атмосфере в конденсате растворяются кислород, азот, углекислый газ в соответствии с их парциальными давлениями, а в промышленных районах - также значительное число оксидов серы и других продуктов, содержащихся в дымовых газах. Суммарное солесодержание атмосферных осадков составляет в среднем 10мг/кг. Просачиваясь через грунт, вода встречается с различными минеральными солями (NaCl, Na2S04, MgS04, СаСОз, силикатами др.) и органическими веществами, растворяет или механически захватывает их. При одновременном присутствии в воде кислорода, органических веществ и микроорганизмов (бакте-рий), постоянно находящихся в поверхностных слоях почвы, создаются условия для перевода основных составляющих ряда органических веществ в минеральные кислоты (углерода в угольную, азота в азотную, серы в серную, фосфора в фосфорную и т. п.). Эти образующиеся в подпочвенных водах кислоты взаимодействуют с широко распространенными в природе известняками - карбонатами кальция, железа, доломитами СаМе(СОз)2 и другими породами, что приводит к поступлению в воду хорошо растворимых бикарбонатов Са, Mg, Fe, например:
| CaCo3+H2CO3=Ca2++2HCO3- | (1.1) |
| 2CaMg(CO3)2+2H2SO4=2Ca2++2Mg2+ +4HCO3-+2SO42- | (1.2) |
| FeCO3+H2CO3=Fe2++2HCO3- | (1.3) |
Коренные горные породы - сложные силикаты (граниты, кварцевые породы) - весьма слабо растворимы в воде и лишь при длительном контакте обогащают воду растворимыми силикатами в небольшой концентрации (5- 15 мг/кг). При прохождении воды через толщу почвы захваченные ею механические грубодисперсные примеси и большая часть коллоидно-дисперсных примесей отфильтровываются, в связи с чем грунтовые (лежащие вблизи поверхности земли) и артезианские (лежащие более глубоко между двумя водонепроницаемыми пластами) воды характеризуются невысокой концентрацией взвешенных и органических примесей. В то же время десорбция углекислоты из таких вод затруднена в связи со слабым газообменом их с атмосферой, что приводит к интенсивному растворению карбонатных пород (см (1.1)-(1.3)) и большему насыщению подземных вод бикарбонатами.
Фильтрация воды через почву частично сопровождается и ионообменной адсорбцией ионогенных примесей; так, почвенные комплексы хорошо задерживают фосфаты, происходит обмен адсорбированного почвой Na+ на К+ и т. п. Поэтому, несмотря на примерно одинаковую распространенность натрия и калия в природе, в поверхностной воде среднее соотношение концентраций [Na+]:[К+] составляет большей частью 10:1.
Подземные водотоки, выходя на поверхность земли, играют значительную роль в питании рек, поэтому солевой состав рек зависит от характера почв и грунтов, с которых они собираются. Вследствие этого воды некоторых северных рек (Печора, Вятка, Нева), стекающих в районах сильновымытых или скальных грунтов, характеризуются малой минерализованностью (около 50 мг/кг). Воды рек южных районов (Эмба, Миус, Амударья), протекающих по сильно засоленным почвам, содержат до 1000 мг/кг растворенных примесей. Если река протекает через районы с различными географическими условиями и геологическим строением (например, Волга), минерализованность ее воды может меняться на протяжении от истока до устья в 2-3 ра-за. Изменением характеристик грунтов и почв) в направлении с севера на юг европейской части СССР определяется эмпирическое правило повышения солесодержания рек в указанном направлении.
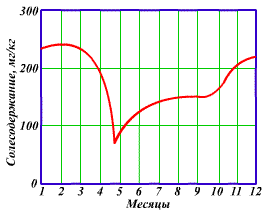
Количественный и качественный составы примесей рек и водоемов зависят от метеорологических условий и подвержены сезонным колебаниям. Так, в весенний паводковый период, после вскрытия льда, воды содержат минимальное количество растворенных солей, однако характеризуются максимальным количеством взвешенных веществ, увлекаемых с поверхности почвы быстрыми потоками талых вод. В зимний период в результате питания поверхностного водотока подземными водами его солесодержание достигает максимума (рис. 1.1.). В летнее время состав речной воды определяется соотношением в питании долей поверхностного и подземного стоков.
Рис 1.1. Изменение солесодержания по временам года
Отмечая географические и сезонные изменения состава природных вод, необходимо учитывать при использовании показателей качества природной воды, с тем чтобы не определять пригодность водотока по результатам единичного наблюдения, выполненного на значительном расстоянии от планируемого места водозабора.
Существенно большим разнообразием примесей по сравнению с природными водами характеризуются производственно - бытовые стоки. По характеру загрязнений эти стоки подразделяют на три группы: бытовые сточные воды; производственные сточные воды; стоки, образующиеся при лесозащитных и растениеводческих работах.
Бытовые сточные воды и стоки лесозащитных и растениеводческих работ с применением реагентов имеют более или менее однообразный состав: белковые вещества и продукты их распада, жиры, мочевина, мыла, синтетические моющие средства, различные инсектициды, удобрения и т. п. Эти примеси в основном относятся к классу органических веществ и в водной среде окисляются под действием кислорода и микроорганизмов.
Загрязнения производственных стоков определяются главным образом типом предприятия, на котором они образуются. Концентрация примесей (кислот, щелочей, нейтральных солей, нефтепродуктов, органических соединений) в сточных водах, подлежащих переработке и повторному использованию, может достигать нескольких граммов на 1 кг воды, и оказывать резко отрицательное влияние на водно - химический и биохимический режимы водотока при аварийных сбросах: снижение концентрации кислорода, изменение рН, отравляющее действие, заиливание и т. п., поэтому бесконтрольный сброс сточных вод в при-родные водотоки и водоемы в СССР и других промышленно - развитых странах запрещен в законодательном порядке.
Природные воды классифицируют по ряду признаков, простейший из них - солесодержание воды: пресная вода - солесодержание до 1 г/кг; солоноватая - солесодержание 1-10г/кг; соленая - солесодержание более 10 г/кг.
Большое распространение получила предложенная О.А.Алекиным система, по которой воды различаются по преобладающему в них аниону: гидрокарбонатный класс вод с преобладающим анионом НСОз или суммой анионов НСОзи СОз (С), сульфатные воды (S), хлоридные воды (С1). По преобладающему катиону классы делятся на три группы: кальциевую (Са), магниевую (Mg) и натриевую, (Na). Группы в свою очередь подразделяются на типы, учитывающие соотношения между ионами, мг - экв/кг. Реки средней полосы европейской части СССР в основном относятся к гидрокарбонатному классу, кальциевой группе (CСa).
Примеси природных вод по степени дисперсности (крупности) подразделяют на истинно - растворенные (ионно- или молекулярно - дисперсные), распределенные в воде в виде отдельных ионов, молекул, коллоидно - дисперсные с размером частиц от 1 до 100 нм, грубодисперсные с размером частиц более 100 нм (0,1 мкм). Данная классификация носит условный характер. Грубодисперсные примеси воды, называемые также суспензиями или взвешенными веществами с частицами размером порядка нескольких микрометров, проявляют свойства, аналогичные коллоидным системам, и их часто объединяют под общим названием микрогетерогенных систем.
Коллоидные примеси представляют собой агломераты из большого числа молекул с наличием поверхности раздела между твердой фазой и водой. Из - за малых размеров коллоидные частицы не теряют способности к диффузии и обладают значительной удельной поверхностью. Например, если кубик вещества объемом 1 см3 раздробить на более мелкие кубики с длиной ребра 10нм, то количество таких кубиков составит 1018 единиц с общей площадью поверхности 600 м2. Коллоидные частицы не выделяются из воды под действием силы тяжести, не задерживаются обычными фильтрующими материалами (песком, фильтровальной бумагой) и различимы в рассеянном свете (конус Тиндаля). В природных водах в коллоидно - дисперсном состоянии находятся различные производные кремниевой кислоты и железа, органические вещества - продукты распада растительных и животных организмов.
Грубодисперсные примеси (так называемые взвешенные вещества) имеют столь большую массу, что практически не способны к диффузии. С течением времени устанавливается определенное седиментационное равновесие, и примеси либо выпадают в осадок, либо всплывают на поверхность (при плотности частиц меньше плотности воды).
Длительно оставаясь во взвешенном состоянии, грубодисперсные примеси обусловливают мутность воды. Чем больше размер частиц грубодисперсных примесей, тем быстрее устанавливается седиментационное равновесие и тем легче выделяются они из воды при отстаивании или фильтровании. Так, скорость отстаивания частиц песка и ила размерами 100 и 20 мкм составляет в неподвижной воде при 10 °С соответственно около 7 и 0,4 мм/с.
По химическому составу примеси природных вод можно разделить на два типа: минеральные и органические.
К минеральным примесям воды относятся растворенные в ней содержащиеся в атмосфере газы Na2, О2, С02, образующиеся в результате окислительных и биохимических процессов МН3, СН4, H2S, а также газы, вносимые сточными водами, различные соли, кислоты, основания, в значительной степени находящиеся в диссоциированной форме, т. е. в виде образующих их катионов и анионов.
К органическим примесям природных вод относят гумусовые вещества, вымываемые из почв и торфяников, а также органические вещества различных типов, поступающие в воду совместно с сельскохозяйственными стоками и другими типами недостаточно очищенных стоков.
Механизм поступления примесей в природную воду формирует определенное постоянство типа важнейших ионов, содержащихся в различных водотоках и водоемах. Сведения о наиболее распространенных в природных водах ионах и их концентрациях приведены в табл. 1.1.
| Группа | Катион | Анион | Концентрация мг/кг |
|---|---|---|---|
| 1 | Na+, K+, Ca2+, Mg2+, | HCO3-, Cl-, SO42- | От нескольких едениц до десятков тысяч |
| 2 | NH4+, Fe2+, Mn2+ | HSiO3-, F-, NO3-, CO32- | От десятых долей до едениц |
| 3 | Cu2+, Zn2+, Ni2+, Al3+ | HS-, J-, NO2-, H2PO4- | Менее десятых долей |
Характеризуя ионизированные примеси, можно отметить следующее.
Ионы натрия и калия с анионами природных вод не образуют труднорастворимых простых солей, практически не подвергаются гидролизу, поэтому их относят к группе устойчивых примесей. Концентрация Na+ и К+ изменяется только в результате испарения или разбавления природной воды, при анализе воды ее часто выражают суммарно.
Ионы кальция и магния относятся к числу важнейших примесей воды и во многом определяют возможность ее использования для различных народнохозяйственных целей, так как эти ионы образуют труднорастворимые соединения с некоторыми находящимися в воде анионами. При использовании природной воды и связанном с этим изменении исходных концентраций катионов и анионов, например при упаривании или снижении растворимости с ростом температуры, происходит выделение труднорастворимых солей кальция и магния на теплопередающих поверхностях в виде твердой фазы. Произведения растворимости некоторых труднорастворимых соединений Са и Mg приведены в табл. 1.2 и 1.3.
| Ионы Ca2+ | Ионы Mg2+ | ||
|---|---|---|---|
| соединение | ПР при 25оС | Соединение | ПР при 25оС |
| CaSO4 | 4.1*10-5 | MgCO3 | 4.0*10-5 |
| Ca(OH)2 | 5.5*10-6 | Mg(OH)2 | 6.5*10-10 |
| CaSiO3 | 6.6*10-7 | MgF2 | 6.4*10-9 |
| Ca3(PO4)2 | 1.0*10-30 | Mg3(PO4)2 | 1.7*10-24 |
| ПР | Температура раствора, оС | ||||
|---|---|---|---|---|---|
| 20 | 40 | 60 | 100 | 200 | |
| ПРCaCO3 | 0.51*10-8 | 0.32*10-8 | 0.19*10-8 | 0.47*10-9 | 0.52*10-11 |
| ПРMg(OH)2 | 6.80*10-10 | 5.37*10-10 | 3.38*10-10 | 1.48*10-10 | -------- | ПРCaSO4 | 4.17*10-5 | 4.08*10-5 | 3.59*10-5 | 4.35*10-6 | 1.19*10-7 |
В технологических процессах подготовки воды для снижения концентрации кальция и магния часто используется образование их труднорастворимых соединений, выводимых из воды до поступления ее в водопаровой тракт.
Ионы железа характеризуются поливалентностью и могут находиться в различных формах: Fe2+ и Fe3+. Необходимо отметить, что обратный логарифм произведения растворимости рПР Fe(он)2 при 25°С равен 14,75 а рПР Fe(OH)3 составляет 37.2 единицы. Исходя из этих значений и ионного произведения воды, можно вычислить, что для поддержания равновесного насыщения воды ионами железа на уровне 0,1 мг/кг для закисного железа рН воды следует довести до 9.2 а для оксидного - до 3,5; при увеличении концентрации Fe3+ в ионной форме рН раствора будет понижаться. Во всех природных водах с высоким рН ионы Fe3 практически не могут содержаться и все соединения F3+ находятся в коллоидной или грубодисперсной форме. В подземных водах железо обычно находится в ионной форме в виде двухвалентного железа, стехиометрически отвечающего формуле соединения Fе(НСО3)2, которое при условии удаления растворенной углекислоты (выдерживание в открытом сосуде) легко гидролизуется, а при наличии в воде растворенного кислорода окисляется с образованием красно-коричневой твердой фазы гидроксида железа Fe(ОН)3:
| 4Fe2++8HCO3-+O2+2H2O=4Fe(OH)3(т)+8CO2 | (1.4) |
В водах поверхностных источников железо может входить также в состав органических соединений; присутствие в воде соединений железа в повышенных концентрациях создает условия для развития железобактерий, образующих бугристые колонии на стенках трубопроводов.
Концентрация железа в исходной воде может увеличиваться в процессе транспортирования ее по стальным и чугунным трубам вследствие загрязнения продуктами коррозии.
Гидрокарбонат - ионы (НСОз) - важнейшая составная часть солевых компонентов воды. В природных водах кроме "полусвязанной"углекислоты (ионы НСО3 - называемые также бикарбонатами), а в некоторых случаях и "связанной" углекислоты (ионы CO3-2) содержится также так называемая "свободная" углекислота, находящаяся в виде растворенного в воде газа СО2 и его гидрата - молекул Н2СО3. Между различными формами угольной кислоты существует кинетическое равновесие, связанное с величиной рН и содержанием ионов кальция в растворе.
Хлорид - ионы (Сl-) с катионами, обычно находящимися в природных водах, не образуют труднорастворимых солей и при температуре около 25°С не подвергаются гидролизу или окислению.
Сульфат - ионы (SO42-) в поверхностных водах, не загрязненных органическими веществами, достаточно устойчивы, как анионы сильной кислоты они не подвергаются гидролизу и образуют относительно труднорастворимую соль только с одним из катионов природных вод - Са2+. Однако растворимость сульфата кальция при обычной температуре достаточно высока (около 1г/кг), и в природных водах, как правило, не происходит выделения твердой фазы CaS04.
Соотношения между взаимосвязанными формами существования угольной кислоты подчиняются закономерностям диссоциации Н2СО3 по I и II ступеням:
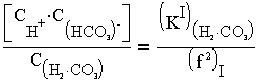
| (1.5) |
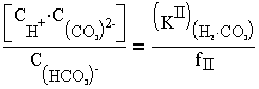
| (1.6) |
где КIH2CO3 и КIIH2CO3 - константы диссоциации угольной кислоты по I и II ступеням, численные значения которых приведены в табл. 1.4; концентраия в воде соответственно молекул Н2СО3 или СО3 и ионов НСО3, CO2 и Н+ моль/кг; fI, fI - коэффициенты активности одно - и двухвалентных ионов (табл. 1.5).
Коэффициент активности зависит от концентрации и валентности всех находящихся в воде ионов, т. е. от так называемой ионной силы раствора, количественно представляющей полусумму произведений молярных концентраций всех находящихся в растворе ионов Сi на квадрат заряда каждого из них Zi:
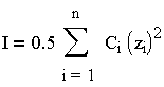
| (1.7) |
| Температура воды, оС | KI, 10-7 | pkI | KII, 10II | pKII |
|---|---|---|---|---|
| 0 | 2.65 | 6.579 | 2.36 | 10.625 |
| 10 | 3.43 | 6.464 | 3.24 | 10.420 |
| 20 | 4.15 | 6.318 | 4.20 | 10.377 |
| 25 | 4.45 | 7.352 | 4.69 | 10.329 |
| 30 | 4.71 | 6.327 | 5.13 | 10.290 |
| 40 | 5.06 | 6.298 | 6.03 | 10.220 |
| 60 | 5.02 | 6.299 | 7.20 | 10.143 |
| 80 | 4.21 | 6.376 | 7.55 | 10.122 |
| Заряд иона | ионная сила раствора I | |||||
|---|---|---|---|---|---|---|
| 0.001 | 0.002 | 0.005 | 0.01 | 0.02 | 0.05 | |
| 1 | 0.97 | 0.95 | 0.95 | 0.90 | 0.87 | 0.81 |
| 2 | 0.87 | 0.82 | 0.74 | 0.66 | 0.55 | 0.44 |
| 3 | 0.73 | 0.64 | 0.51 | 0.39 | 0.28 | 0.15 |
Приближенно коэффициент активности данного иона связан с ионной силой раствора уравнением:
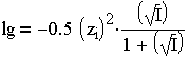
| (1.8) |
Коэффициент активности молекул условно принимают равным 1.
Из уравнений диссоциации угольной кислоты в водном растворе следует, что соотношение между ее формами С02, НСО3- и CO3- при данной температуре зависит от концентрации водородных ионов, т.е. значения рН.
Рис 1.2. Соотношение форм углекислоты в зависимости от pH воды ( при t=25oC)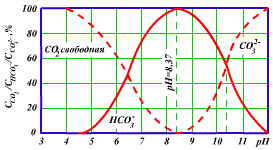
Из рис. 1.2, подтверждающего это соотношение, видно, что при рН=4.3 вся находящаяся в воде углекислота представлена практически только одним соединением СO2 и ее гидратированной формой Н2СО3, составляющей, однако, лишь десятые доли процента суммарной концентрации (СО2+Н2СО3). С увеличением рН доля С02 уменьшается при одновременном увеличении доли НСО3-, и при значении рН=8.35 практически вся угольная кислота присутствует в воде в форме бикарбонат - ионов, а при повышении рН до 12 она представлена только ионами СО3-.
Существующее между различными формами угольной кислоты равновесие суммарно выражается уравнением:
| 2HCO3-=CO3-+CO2+H2O | (1.9) |
Из этого уравнения следует, что для поддержания в растворе определенной концентрации НСО3 требуется, чтобы в воде присутствовало эквивалентное этой концентрации количество свободной "равновесной углекислоты" С02. Так как растворимость С02 зависит от температуры и парциального давления СO2 в воздухе, контактирующем с раствором, при определенных условиях содержание СО3 в воде может оказаться меньше или больше значения, соответствующего расчетному равновесному содержанию ее в системе НСО3 - С02. Это приведет к смещению равновесия по уравнению (1.9) вправо или влево и вызовет изменение концентрации СО3 по отношению к его равновесному значению. Система (т. е. природная вода, содержащая Са2++НСО3, СО2, СО2), может оказаться неустойчивой и в ней самопроизвольно начнут протекать процессы, приводящие к восстановлению равновесия (принцип Ле - Шателье) и сопровождающиеся выделением из раствора твердой фазы СаСО3 (избыток ионов CO2 ) либо растворением твердой фазы СаСО3 (недостаток по отношению к равновесному значению ионов СO3-). На этом основании воду с фактическим (определенным аналитически) содержанием С02, равным ее расчетной по уравнению (1.9) равновесной концентрации, называют стабильной. При содержании С02, большем ее равновесной концентрации, избыток ее способен вызывать растворение СаСО3 при контакте воды, например, с бетонными сооружениями, доломитовыми и известняковыми породами, поэтому такую воду называют агрессивной. Наоборот, при недостатке С02 по сравнению с равновесной концентрацией будет наблюдаться распад части бикарбонатных ионов с образованием дополнительного количества карбонатных ионов и выделением из системы твердой фазы карбоната кальция по уравнению:
| Ca2++CO3-=CaCO3(т) | (1.10) |
Такую воду называют нестабильной
Для определения показателя стабильности кроме расчетных и номограммных методов можно применять прямые экспериментальные методы (так называемые карбонатные испытания). Концентрацию равновесного диоксида углерода в зависимости от щелочности и рН природной воды в пределах 5,5 - 8,3 можно определить по упрощенной формуле (1.11), полученной совместным решением уравнений (1.5.) и (1.8.)
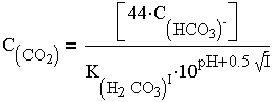 |
(1.11) |
где CCO2 - содержание в воде свободного диоксида углерода, мг/кг; CHCO3 - концентрация бикарбонатов в воде, мг - экв/кг. Формулу (1.11) можно представить приближенно в виде зависимости:
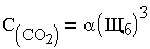 |
(1.12) |
в которой для вод с солесодержанием 100 - 400 мг/кг 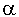 = 0,268.
= 0,268.
Кремниевая кислота. Различные соединения кремниевой кислоты весьма распространены в природных водах; в подземных водах силикатов содержится обычно больше, чем в поверхностных. Ангидрид кремниевой кислоты (Si02) с водой может образовывать кислоты типа метакремниевой Н2Si3 (Si02*H20), ортокремниевой H4Si04 (Si02-2H20) и различных поликремниевых, например двуметакремниевой H2Si2O5 (2Si02-H20) и т. п. Все эти кислоты при обычных для природных вод значениях рН малорастворимы и способны образовывать в воде коллоидные растворы. Многообразие форм кремниевых кислот и сравнительно малая их растворимость в воде (например, кремнесодержание в воде при t=20°C достигает 150 мг/кг, при t=100°С 500 мг/кг) сильно затрудняют их дифференциацию при анализе воды, поэтому в результате анализа обычно получают только суммарную концентрацию кремнесодержащих соединений, условно выраженную в виде SiO2, так называемое кремнесодержание воды.
Кальциевые и магниевые соли кремниевых кислот различных типов, а также ферро - и алюмосиликаты значительно труднее растворяются в воде.
В поверхностных и артезианских водах общее кремнесодержание в пересчете на SiO32- обычно составляет от 1 до 30 мг/кг, при этом от 5 до 20 % SiO32- представлено коллоидной формой. При значениях рН>8 кремниевая кислота может находиться в воде в виде HSiO3- лишь в отсутствие ионов Са2+ и Mg2.
Органические примеси. Органические вещества, попадающие в открытые водоемы в результате вымывания из почв и торфяников, объединяют обычно под общим названием гумусовых. Особенно загрязнены гумусовыми веществами, имеющими характерную желтую или коричневую окраску, водотоки болотного происхождения. Кроме того, поверхностные воды обогащаются органическими веществами в результате отмирания водной флоры и фауны с последующими процессами их химического и биохимического распада.
Гумусовые вещества природных вод разделяют условно на три группы, объединяющие органические примеси по более или менее близким физическим и химическим свойствам: 1) гуминовые кислоты [примерная формула С60H52O24] обычно находятся в водоемах в виде коллоидов, переходя в истинно растворенное состояние лишь при высоких значениях рН; 2) коллоидные соединения фульвокислот; 3) истинно растворенные соединения фульвокислот.
Водород карбоксильных групп СООН гуминовых кислот может замещаться катионами с образованием солей, называемых гуматами. Гуматы щелочных металлов и аммония хорошо растворимы в воде, в то время как гуматы кальция, магния и железа труднорастворимы. Гуминовые кислоты могут также образовывать с гидроксидами железа и алюминия комплексные соединения, частично представленные и коллоидной формой.
Большое значение в увеличении количественного и качественного содержания органических веществ в поверхностных водоемах и водотоках играют недостаточно очищенные бытовые, производственные, а также сельскохозяйственные стоки. Известно, что органические вещества являются главной причиной ухудшения органолептических свойств воды, т. е. появления запахов и привкусов.
Из - за сложности индивидуальной классификации органических примесей каждого типа в практике анализа используют общую способность органических примесей окисляться под действием специфических окислителей. Этот критерий не дает точного представления о реальной концентрации органических веществ в воде, однако позволяет приближенно характеризовать и сравнивать воды различного типа.