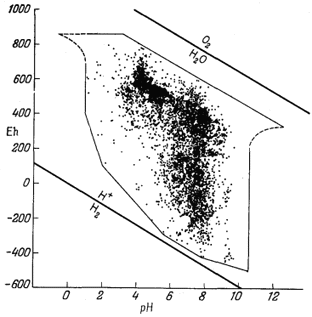
Фиг. 11.1. Результаты измерения Eh и рН в природных водах [1, стр. 276].

Фиг. 11.2. Приблизительное положение некоторых природных сред на диаграмме Eh - рН.
| Р.М. Гаррелс, Ч.Л. Крайст | Растворы, минералы, равновесия |
|
|
|
|
[Содержание] [Глава 10] [Приложение 1] |
|
|
|
|
Настоящая глава
представляет собой обзор некоторых возможных случаев использования
диаграмм устойчивости минералов при решении ряда геологических вопросов.
Она в какой-то степени познакомит читателя с соответствующей литературой
и, кроме того, наметит пути применения всех тех диаграмм, описанию которых
были посвящены предыдущие главы. Приводимые в главе примеры подобраны с
таким расчетом, чтобы лучше показать значение диаграмм устойчивости
твердых веществ. Имеется обширная дополнительная литература, особенно на
русском языке, в которой приводятся сведения о параметрах растворов и
рассматривается вопрос о влиянии этих параметров на присутствие тех или
иных твердых веществ. Здесь же мы использовали лишь те работы, выводы
которых были представлены графически. Этот прием позволил сократить объем
книги и достичь гармонии с предыдущими главами, посвященными
преимущественно разбору диаграмм. Вместе с тем основное внимание будет
обращено на диаграммы Eh - рН как на наиболее широко используемый метод
исследования. Возможно, что через несколько лет число характеристических
переменных для описания подобных соотношений заметно возрастет.
Выбор диапазона значений Eh и рН при построении диаграмм определяется теми границами, которые характерны для природных условий. Бекинг, Каплан и Моор [1] в своей очень важной работе, посвященной этому вопросу, собрали практически все имеющиеся к настоящему времени в литературе результаты измерений Eh и рН природных вод. На фиг. 11.1, заимствованной из их работы, эти величины показаны графически; таким образом, эта фигура может служить прекрасной иллюстрацией как пределов значений Eh и рН, так и частоты их встречаемости. Упомянутые выше исследователи подробно рассмотрели факторы, определяющие, величины Eh и рН (обратив при этом особое внимание на биологические аспекты вопроса), и сопроводили свой труд обширным списком литературы. Фиг. 11.2 отражает попытку изобразить положение наиболее часто встречающихся замеров Eh и рН природных вод некоторых типов. Обратите внимание, что результаты измерений большинства аэрированных поверхностных вод (рудничные, дождевые, речные и обычные морские воды на фиг. 11.2) отчетливо располагаются вдоль линии, проходящей немного ниже верхней границы устойчивости воды, и что эта линия примерно параллельна границам устойчивости воды. Данная линия, отвечающая "необратимому кислородному потенциалу", была истолкована Сато [34] как граница устойчивости Н2О2 - O2 на том основании, что окисление воды растворенным кислородом должно пройти через стадию перекиси водорода, контролирую-
 |
|
Фиг. 11.1. Результаты измерения Eh и рН в природных водах [1, стр. 276]. |
 |
|
Фиг. 11.2. Приблизительное положение некоторых природных сред на диаграмме Eh - рН. |
щую скорость процесса. Если считать, что измеренные потенциалы действительно отражают- влияние атмосферного кислорода, то природные воды ведут себя таким образом, как будто количество растворенного в них кислорода очень невелико. Однако в окисленных ванадиевых рудах, например, встречается навахоит1 (стр.316), который, устойчив только при потенциале, равном примерно 1 в, и значениях рН от 1,5 до 2. На фиг. 11.3 показано, что в рудничных водах измеренные значения Eh и рН характеризуются широким разбросом, причем пробы вод,. защищенных от влияния атмосферного кислорода (зона первичных руд), попадают в группу промежуточных вод на фиг. 11.2. Так как многие горные породы-осадочные, изверженные и метаморфические - содержат одновременно и магнетит и гематит то весьма вероятно, что потенциалы большинства подземных вод близки к границе магнетит - гематит (фиг. 7.3).
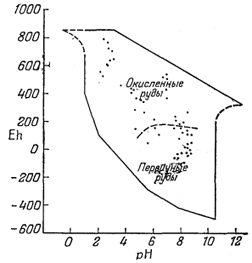 |
| Фиг. 11.3. Величины Eh и рН рудничных вод. Сделана попытка разделить воды, поступающие из области первичных руд, и воды, просачивающиеся сквозь окисленные руды [1, стр. 255]. |
В общем выясняется, что
окислительными могут, быть только поверхностные воды при хорошей их
циркуляции. Застойные воды быстро теряют растворенный кислород вне
зависимости от того, обусловлена ли застойность фиксацией вод в порах
горных пород или же она возникла при отсутствии перемешивания в открытых
водах. Воды, лишенные органических остатков, теряют свою окислительную
способность. вследствие реакций с силикатами, содержащими двухвалентное
железо, такими, как биотит, хлорит, амфиболы, пироксены, или же из-за
взаимодействия с сульфидами и железистыми карбонатами., В природе известно
много других возможных неорганических восстановителей; однако в
количественном отношении главнейшими восстановителями, по-видимому,
являются перечисленные соединения железа. В связи с гидролизом силикатов
рН вод обычно повышается и, таким образом, по мере восстановления среды
становятся все более щелочными. В средах, содержащих органическое
вещество, кислород быстро связывается в процессе биохимических реакций,
что обычно сопровождается увеличением концентрации CO2 и
образованием сероводорода. При главенствующей роли бактерий2 (стр.316) в процессе
связывания кислорода образование CO2 и H2S
сопровождается понижением рН. Некоторые бактерии даже выделяют водород, а
потому потенциалы таких сред могут опуститься почти до самого предела
устойчивости воды. При отсутствии органического вещества многие ионы,
особенно сульфатные, метастабильно существуют в течение довольно
длительного времени, но наличие органического вещества и сопутствующих
бактерий почти всегда гарантирует приближение среды к равновесному
состоянию, что и отмечается при непосредственном измерении потенциалов.
Можно полагать, что ниже уровня грунтовых вод среда бывает щелочной и
восстановительной, за исключением тех част-
|
1 (стр.316) Минерал состава VО2(ОН)ЧН2O.- Прим, ред. 2 (стр.316) Для детального ознакомления с ролью микроорганизмов в контроле условий среды читателю следует обратиться к работе Бекинга с соавторами [1]. |
ных случаев, когда воды обладают высокой
скоростью просачивания. Наилучшее тому доказательство - сохранение в рудах
сульфидов в течение миллионов лет без нарушения тончайших характерных
деталей их поверхности.
Классической работой по осадочным рудам железа, в которой наблюдаемые фации увязываются с определенными свойствами среды, следует признать исследование Джеймса [28]. Приведем авторскую аннотацию, в которой основные выводы работы излагаются в самом сжатом виде:
"В
докембрийских осадочных железистых формациях района озера Верхнего по
преобладающим первичным минералам эрелеза можно выделить четыре фации:
сульфидную, карбонатную, окисную и Силикатную. Поскольку эти породы
представляют собой хемогенные осадки, они фиксируют определенные условия
среды в период осадконакопления. Главным контролирующим фактором, по
крайней мере при образовании сульфидной, карбонатной и окисной фаций, был,
вероятно, окислительный потенциал. Имеющиеся данные свидетельствуют о том,
что осадконакопление происходило в замкнутых бассейнах, отделенных от
открытого моря порогами. Последние препятствовали свободной циркуляции вод
и способствовали возникновению аномалий в составе вод и в их окислительных
потенциалах.
... Сульфидная фация
представлена черными сланцами, содержащими до 40% пирита. Количество
свободного углерода в этих породах обычно колеблется в пределах от 5 до
15% , что свидетельствует о чрезвычайно застойном характере вод в период
осадконакопления. Кое-где в этих пиритоносных породах содержатся прослойки
железистого карбоната. Карбонатная фация в ее наиболее чистом виде
представлена толщей переслаивания железистых карбонатов с роговиками.
Формирование этой фации происходило из среды с концентрацией кислорода,
достаточно высокой для разрушения большей части органического вещества, но
недостаточной для образования соединений окисного железа. Окисная
фация встречается в двух основных разновидностях: одна из них
характеризуется преобладанием магнетита, а другая - тематита. Судя по
всему, оба минерала имеют первичное происхождение. Слоистая магнетитовая
порода - одна из наиболее широко распространенных литологических фаций в
районе; она представлена в основном магнетитом, переслаивающимся с
роговиком, карбонатом или силикатом железа или же со всеми одновременно.
Состав и ассоциации минералов в этих породах наводят на мысль об их
образовании в условиях слабо окислительной или умеренно восстановительной
среды, хотя остается неясным, каким образом в таких условиях происходило
отложение магнетита. Полосчатые гематитовые породы состоят из
мелкокристаллического гематита, переслаивающегося с роговиком или яшмой.
Обычны оолитовые текстуры. Эта фация, несомненно, формировалась в сильно
окислительной среде и, вероятно, в прибрежной зоне, т. е. в условиях,
подобных условиям образования молодых гематитовых железняков, например
района Клинтона. Силикатная фация состоит главным образом из одного
или нескольких гидросиликатов железа (гриналита, миннесотаита,
стильпномелана, хлорита)... Сидикатные породы обычно встречаются либо
совместно с карбонатными, либо вместе с магнетитовыми породами. Отсюда
можно заключить, что оптимальными для отложения силикатной фаций были
условия от слабо окислительных до слабо восстановительных...".
Выводы Джеймса нетрудно сопоставить с равновесными соотношениями, представленными на фиг. 7.23. Если раствор несколько недосыщен в отношении аморфного кремнезема, магнетит будет замещать силикаты железа; при уменьшении значения SCO2 магнетит или силикат железа замещают сидерит; при увеличении концентрации сульфидной серы на смену всем этим минералам приходит пирит; при повышении активности кислорода главным минералом становится гематит. Интересно, что образование всех этих фаций идет в узком пределе значений рН и Eh. Кастаньо и Гаррелс [б], а также Хьюбер и Гаррелс [27] экспериментально показали, что в лабораторных условиях минералы железа осаждаются в соответствии с метастабильнымй соотношениями, изображёнными на фиг. 7.4, и что свежеосажденные "гидроокислы" и карбонаты железа весьма чутко реагируют на изменение условий рН и Eh среды, Замечательное исследование по расшифровке зависимости возникновения различных железистых фаций от условий осадконакопления выполнил Уайт [37], которому удалось связать последовательность образования этих фаций со степенью аэрации вод и расстоянием от берега. Керрол [5] высказала предположение, что во многих случаях железо переносилось к месту отложения в виде рубашки окиси железа на поверхности глинистых минералов и что вынос и, концентрация железа, вероятно, происходили после формирования первичного осадка, если среда изменялась таким образом, что допускала восстановление окисного железа и выпадение его в осадок. Керрол проделала серию экспериментов, результаты которых указали на возможность изменения Eh и рН среды с помощью, бактерий до таких значений, которые обусловливали растворение окиси, железа; такой раствор действительно был получен.
Серьезным вкладом в изучение химии железа в природных водах явились последние работы Хема и его сотрудников [18-22], а также Штумма и Лее [35]. Благодаря детальнейшему изучению природных вод и их лабораторных аналогов этим исследователям удалось, по сути дела, показать, что по результатам измерения Eh и рН в сочетании с необходимыми термодинамическими данными можно определить концентрации и вид компонентов железа в растворе. Такие же исследования нужно проделать и для других элементов. В упомянутых выше работах Хема и его сотрудников, а также Штумма и Лее приведены многочисленные диаграммы Eh - рН для твердых веществ и растворов.
Итак, данные изучения
природных соотношений минералов железа позволяют сделать следующий вывод:
отложение этих минералов происходило в условиях, достаточно близких к
равновесию со средой, чтобы можно было использовать термохимические методы
исследования. Соответствующие диаграммы не говорят ни о скорости, с
которой может быть достигнуто равновесие, ни о пути, по которому оно будет
достигнуто. Однако, если нам известен конечный результат, мы имеем право
использовать устойчивые ассоциации для интерпретации природных процессов
на основании выявленной последовательности замещения одних минералов
другими. Так, мы можем установить допустимые границы концентрации
CO2 в растворе, необходимой для образования сидеритовой фации,
и доказать, что во время отложения сидеритовой, пиритовой, магнетитовой
или силикатной фаций железистой формации кислород должен практически
отсутствовать. Важно также знать, что наличие даже незначительного
количества сульфидной серы в богатой железом среде скажется в образовании
пирита и что одновременное существование пирита и пирротина возможно в
довольно узких пределах значений суммы растворенной серы, равновесной по
отношению к этим двум соединениям. Основной пробел в наших знаниях
заключается в отсутствии термохимических данных для первичных силикатов
железа в осадочных железных рудах; поэтому при расчетах приходится
рассматривать лишь соединение FeSiO3, хотя в природе минерал с
таким составом неизвестен. Весьма серьезную проблему составляет также
сосуществование кремнистого вещества и магнетита как первичных минералов,
с одной стороны, и силикатов железа - с другой. Суть дела заключается в
том, что-в рассматриваемых уравнениях должны учитываться реальные
силикаты, содержащие алюминий.
При исследовании осадочных марганцевых месторождений диаграммы Eh-рН были применены Краускопфом [31] и Маршандизом [33]. На фиг. 11.4 приведена диаграмма, заимствованная из статьи Краускопфа; на ней показано положение границ устойчивости между безводными соединениями марганца. Обратите внимание, что Краускопф предпочитает изображать уравнения, относящиеся к каждой паре минералов, не выделяя полей устойчивости отдельных минералов, как это делали авторы настоящей книги. На фиг. 11.5 приведена его диаграмма для гидроокислов марганца. И в этом случае при изложении выводов, сделанных по представленным диаграммам, лучше всего воспользоваться авторской аннотацией [31, стр. 61]:
"Термохимические данные для соединении марганца и железа в общем
соответствуют наблюдаемым минеральным ассоциациям; при этом надо учесть,
что более сложные по составу природные минералы, для которых такие данные
неизвестны, обладают несколько большими полями устойчивости, чем самые
близкие к ним простые химические эквиваленты. Приведенные данные
показывают, что природные соединения железа всегда менее растворимы, чем
соответствующие соединения марганца, и что при любых значениях Eh и рН,
наблюдаемых в природных средах, ион двухвалентного железа окисляется
значительно легче, чем ион. двухвалентного марганца. Следовательно,
неорганические процессы всегда должны приводить к осаждению железа ранее
марганца из растворов, содержащих оба металла, за исключением тех случаев,
когда отношение Mn/Fe очень высоко
Окисление ионов
Мn2+ и Fe2+ атмосферным кислородом происходит в
результате медленно идущих реакции, которые могут быть использованы
бактериями в качестве источника энергии. Селективное окисление и осаждение
железа и марганца различными видами бактерий могут привести к частичному
разделению этих металлов, хотя, судя по всему, деятельность бактерий не
является главным фактором возникновения крупных месторождений почти чисто
марганцевых или железных руд.
Высказывалось мнение, что
разделение железа и марганца происходит вследствие селективного
растворения этих металлов из разрушающихся горных пород. Этот процесс был
исследован путем обработки андезито-базальта самыми различными
растворителями при температурах от 25 до 300° С. Оказалось, что в
получавшихся растворах отношение марганца к железу всегда оставалось почти
таким же, как и в первичной породе. Отсюда следует, что предполагавшийся
процесс разделения железа и марганца не будет эффективным.
Обособление марганца в
растворе может быть следствием более раннего осаждения железа. Этот
процесс идет особенно эффективно, если к раствору, содержащему оба
металла, постепенно добавлять щелочь и поддерживать постоянный контакт
раствора с атмосферным кислородом. Данную реакцию можно продемонстрировать
в лаборатории, создав условия, подобные природным. Для этого следует
пропустить разбавленный кислый фильтрат через измельченную лаву, а затем
через известняк: железо, вынесенное из лавы, осадится в известняке, а в
растворе создастся высокое отношение Мn к Fe. Приведенный пример,
по-видимому, объясняет генезис многих марганцевых месторождений, особенно
тех из них, которые ассоциируют с лавами и туфами1 (стр.319). Однако
подобное объяснение удовлетворительно лишь в том случае, когда в породах,
через которые просачивались растворы, масса отложенных окислов железа во
много раз превышала количество окислов марганца.
|
1 (стр.319) Здесь авторы не подчеркивают очень важного обстоятельства: кислый фильтрат нейтрализуется известняком и становится слабо щелочным и только из щелочных растворов может осаждаться МnО2. В кислых растворах Eh MnO2 выше границы устойчивости воды.- Прим. ред. |
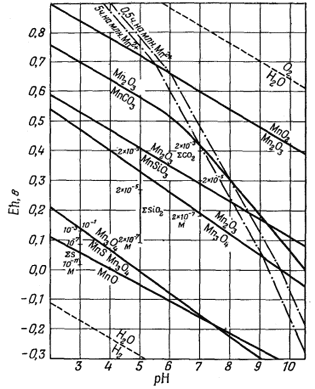 |
|
Фиг. 11.4. Диаграмма Eh - рН для безводных
соединений марганца. |
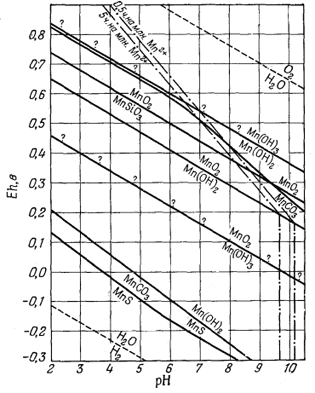 |
|
Фиг. 11.5. Диаграмма Eh - рН для гидроокислов
марганца. |
Диаграммы Eh - рН особенно
полезны при изучении процессов окисления и вторичного обогащения рудных
месторождений. Температура и давление этих процессов близки к 25° С и 1
атм общего давления а диапазон возможных значений Eh и рН весьма
широк. В отличие от большинства других приповерхностных сред концентрация
легко окисляющихся или восстанавливающихся веществ здесь очень высокая, а
разнообразие минеральных видов весьма велико.
Урановые месторождения, относящиеся к так называемому типу ураноносных песчаников, залегают в континентальных осадках в виде линзо-образных тел или пластов. Поистине бесконечное разнообразие в отноше ниях между минералами этих месторождений представляет благодатный материал для исследователя минеральных ассоциаций. Вплоть до 1950 г когда месторождения юго-западной части штата Колорадо оставались наи более известными в США главным урановым минералом считался карнотит уранил-ванадат калия K2(UO2)2V2O8Ч0 - 3Н2O; многие принимай его за первично осадочный минерал, образовавшийся одновременно или вскоре после отложения вмещающих осадочных пород (см., например, [11]) Этот минерал, несомненно, возник в результате полного окисления так как в него входят шестивалентный уран и пятивалентный ванадии. Однако открытие на более глубоких горизонтах месторождений все возрастают количеств уранинита1 (стр.321) поставило исследователей перед проблемой вaлентности, так как в уранините по меньшей мере часть урана находится в четырехвалентной форме. Отсюда возникло предположение, что уранинит,-вероятно, ранний урановый минерал, а карнотит - продукт его окисления. Эта идея получила подтверждение после идентификации минерала монтро-узита [VO(OH)], в состав которого входит трехвалентный ванадий Проблема представится еще более сложной, если мы укажем, что были установлены и другие ванадиевые минералы, содержащие одновременно V3+ и V4+, один V4+, а также V4+ вместе с V5+.
В настоящее время карнотит обычно считают продуктом выветривания Этот вывод - результат огромной работы многих исследователей; здесь мы рассмотрим лишь часть общей проблемы, сопоставив условия нахождения минералов с теоретическими соотношениями устойчивости. Этот честный вопрос можно сформулировать следующим образом: если неокисленная урановая руда состоит из уранинита, монтроузита и пирита с подчиненным количеством сфалерита и галенита, то приведет ли ее окисление к oбразо ванию той сложной совокупности минералов, которую мы наблюдаем? Какие продукты окисления могут устойчиво сосуществовать? Какие минералы будут окисляться первыми в условиях, близких к равновесным? Для изображения соотношений устойчивости лучше всего использовать диаграммы Eh - рН, так как, совмещая частные диаграммы, можно сравнить поведение различных элементов, править поведение различных элементов.
Первыми диаграммами такого
рода явились грубые предварительные графики, для ванадия и урана, [13,
15]. Однако уже с их помощью удалось показать, что уранинит и монтроузит
могут сосуществовать в сильно восстановительных условиях, но что в воде
монтроузит окисляется при более
|
1 (стр.321) Уранинитом американские авторы называют не только кристаллическую UO2 но и ее землистые разности, известные как урановые черни.- Прим. ред. |
 |
|
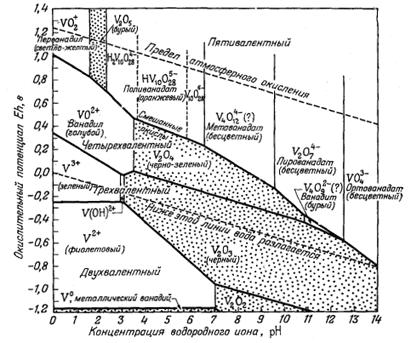
Фиг. 11.6а. Устойчивость некоторых соединений и ионов ванадия в воде при 25° С и 1 атм общего давления [10]. |
 |
|
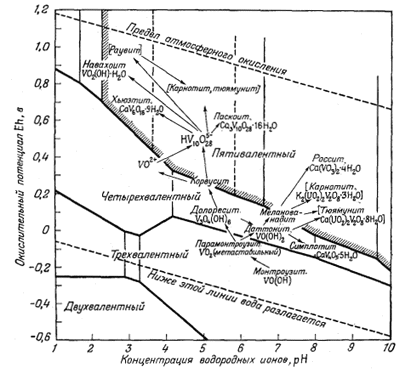
Фиг. 11.66. Диаграмма Eh--рН, иллюстрирующая последовательность окисления некоторых природных соединений ванадия [10]. |
 |
|
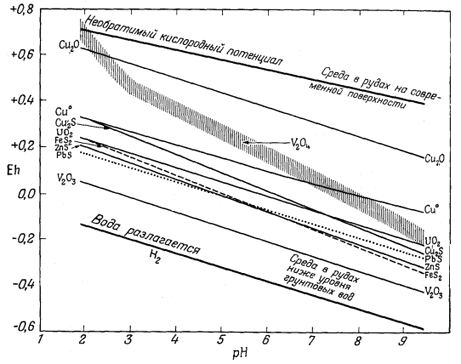
Фиг. 11.7а. Пределы устойчивости некоторых минералов из урановых руд месторождений плато Колорадо [16, воспроизводится с разрешения Американского геологического института]. |
 |
|
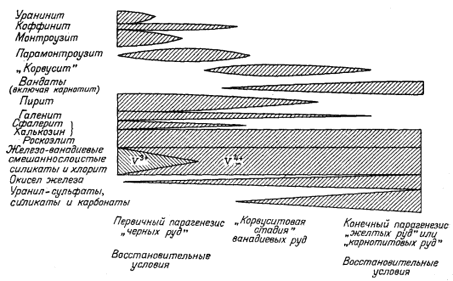
Фиг. 11.7б. Примерные соотношения между некоторыми рудными минералами в общей последовательности окисления урановых руд на месторождениях плато Колорадо [16]. |
низком потенциале, чем уранинит. Поэтому уранинит может сосуществовать с окислами ванадия, содержащими этот элемент в трех- или четырехвалентном состоянии. Вслед за первыми грубыми графиками были построены две диаграммы, главным автором которых являлся Ивенс [10]. В этих диаграммах сравнивались теоретические соотношения между самыми различными кислородными соединениями ванадия и их ионами с наблюдаемой последовательностью образования ванадиевых минералов на месторождениях плато Колорадо (фиг. 11.6а и 11.6б). По этим диаграммам можно не только найти место уже известным минералам, но и предугадать условия нахождения новых минералов. Тогда же была построена сводная диаграмма, на которой показаны границы окисления для различных соединений [16],
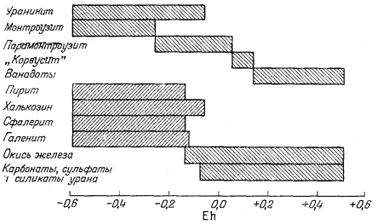 |
|
Фиг. 11.7в. Предполагаемая последовательность окисления урановых руд при условии, что во время непрерывного повышения окислительного потенциала при рН 7 равновесие сохраняется [16]. |
что позволило обнаружить некоторые интересные соотношения. В частности, оказалось, что наблюдаемая последовательность образования минералов в процессе окисления первичных уранинит-монтроузит-сульфидных руд в точности соответствует последовательности превращений, которую можно предсказать, исходя из допущения о постепенном окислении такой руды при сохранении условий, близких к равновесным [фиг. 11.7а - 11.7в]. Хостетлер и Гаррелс [26] с помощью диаграмм Eh - рН определили поля "растворимости" и устойчивости твердых веществ в сложной системе U - V - К - O2 - СО2 - H2O. Целью этого исследования было выяснение условий переноса урана подземными водами в присутствии ванадия. Некоторые из полученных выводов показаны на фиг. 11.8, а - в. Анализ фигур позволяет определить положение полей устойчивости различных твердых соединений и условия среды, при которых осуществляется перенос значительных количеств ванадия и урана.
Диаграммы Eh - рН были использованы также Колеманом и Делево [7] для объяснения поведения селена в процессе выветривания.
Итак, и в рассмотренных
случаях соотношения, рассчитанные на основании термохимических данных,
оказались полезны при исследовании природных минеральных образований.
На фиг. 11.9 представлена сводная диаграмма, характеризующая условия Eh - рН При процессах окисления обычных сульфидных руд; эта диаграмма построена Гаррелсом [14]. Состав продуктов окисления и их
общее поведение в зоне выветривания, установленные путем расчетов, достаточно хорошо соответствуют наблюдаемым фактам с той лишь оговоркой, что для многих фаз термохимические данные отсутствуют. Приводимая диаграмма дает возможность количественно определить границы между окисленным и устойчивым состояниями сульфидов; с ее помощью можно также выявить и некоторые частные закономерности, например возможность устойчивого сосуществования окисленных цинковых минералов с сульфидами меди вроде халькозина. Рассмотренная диаграмма довольно примитивна; подобные диаграммы, рассчитанные Натарайаном и Гаррелсом и приведенные на фиг. 7.24 и 7.25, уже значительно более совершенны; по мере получения новых данных их можно будет уточнять. Определенный интерес представляет сравнение реальных и теоретических соотношений, проведенное Фронделем и Ито [12]; эти исследователи показали, что германиеносные сульфидные руды месторождения Цумеб в основном окисляются именно так, как можно было предположить теоретически.
Келли и Клоук [29] изучали
вопрос о факторах, определяющих растворимость золота в зоне окисления
рудных тел. Им удалось установить, что золото заметно растворяется при
низком значении рН, высоком окислительном потенциале и при большой
концентрации хлоридного иона в подземных водах. Поведение золота они
описали графически, использовав с этой целью в качестве переменных Eh, рН
и активность иона хлора.
Вопросы, связанные с изучением условий образования морских осадков, освещены в весьма обширной литературе, однако при интерпретации химизма этих процессов диаграммами Eh - рН пользуются еще очень редко. Вместе с тем при качественной характеристике среды осадконакоп-ления авторы ряда работ нередко оперируют величинами Eh и рН (см., например, [8, 36]). Краускопф [30], исследуя поведение редких элементов в морской воде, использовал диаграммы устойчивости, чтобы показать активности ионов в состоянии равновесия с различными возможными стабильными твердыми веществами. Крамбейн и Гаррелс [32] предложили качественную классификацию самых различных химических осадков в координатах Eh - рН (фиг. 11.10). К сожалению, большая часть минералов так близка к равновесию с морской водой, метастабильность их столь обычна, а термохимические данные настолько приближенны, что пройдет еще немало времени, прежде чем удастся выяснить, какие минералы находятся в равновесии в условиях морского дна. Если бы соответствующие диаграммы были построены, мы получили бы мощное орудие исследования возможной роли скорости реакций и адсорбционных явлений как факторов контроля ионного состава океанической воды, действующих в противовес стремле-
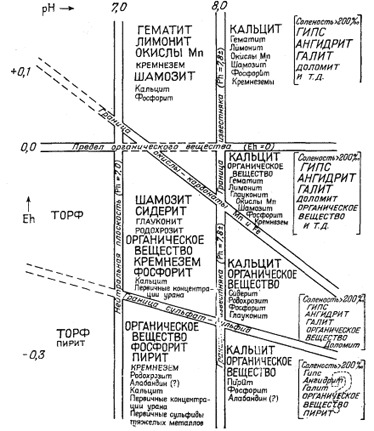 |
|
Ф и г. 11.10. Конечные ассоциации в химических
осадках и характерные для них условия среды в зависимости от Eh и
рН. |
нию его к равновесию с твердыми фазами. Наконец, мы
смогли бы уяснить влияние различных типов растворимых комплексов на
величину растворимости различных соединений, а также критически
рассмотреть вопросы, связанные со способностью живых организмов оказывать
решающее влияние на осаждение минеральных веществ.
Исследование соотношений между минералами и сосуществующими с ними растворами имеет огромное значение для дальнейшего изучения процессов рудообразования. Однако достижения в этой области невелики, что в основном связано с трудностями проведения экспериментов при высоких температурах и давлениях. Чтобы получить точные анализы водных растворов, сосуществующих с различными твердыми веществами, исследователь должен проявить изобретательность, высокое мастерство и чрезвычайную аккуратность. Чисто теоретическому решению проблемы препятствует недостаточность термохимических данных. Однако в настоящее время интерес к исследованию особенностей водных растворов при высоких температурах и давлениях велик не только у части геохимиков, пионеров этого нового направления, но и у физико-химиков. В этой области знаний можно ожидать быстрого прогресса.
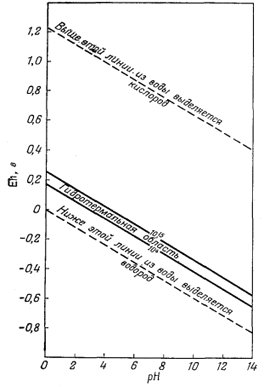 |
|
Фиг. 11.11. рН - Eh-диаграмма для гидро-термальных
рудообразующих растворов [4, стр. 345]. |
Некоторые возможности в этом отношении выявлены Бартоном [4], который осуществил превосходное исследование природы рудообразующей среды, основываясь на изучении минеральных ассоциаций в жилах. На фиг. 11.11, заимствованной из работы Бартона, отражены его выводы относительно Eh и рН образования некоторых руд. Этот автор отчетливо представлял себе, насколько ограниченны его возможности из-за отсутствия данных по свободным энергиям при тех температурах, которые характерны для процессов рудоотложения. Барнс и Куллеруд [3] с помощью дополнительных данных построили ряд диаграмм рН - PO2 Для температур до 250° С. Типичная диаграмма из этой работы приведена на фиг. 11.12.
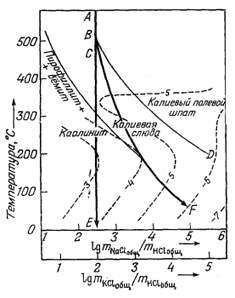
Новую эру в проведении исследований в данном направлении открыл Хемли со своими сотрудниками [23, 24], которые предприняли систематическое изучение соотношений между раствором и твердыми веществами в системах, содержащих полевые шпаты, слюды и другие алюмосиликаты. Этой работой воспользовался Хельгесон [17], чтобы в сочетании с собственными данными по растворимости сульфида свинца оценить изменение состава рудообразующих растворов с изменением температуры (фиг. 11.13).
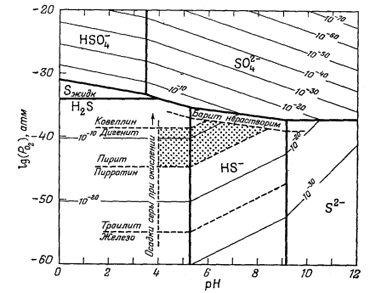 |
|
Фиг. 11.12. Общие пределы кислотности и окислительного состояния сфалеритобразующих растворов при SS = 0,1 М и 250° С [З]. |
В работах Хельгесона [17] и Барнса и Хельгесона [2] сведены все имеющиеся данные по константам ионизации в водных растворах при высоких температурах.
|
Фиг. 11.13. Диаграмма, на которой среда
рудоотложения характеризуется температурой и отношениями
концентраций NaCl, HCl и КСl. |
 |
В настоящее время во многих опубликованных работах парциальные давления газов используются в качестве характеристических переменных при описании равновесных соотношений между рудными и жильными минералами. Среди этих работ следует отметить исследование Краускопфа [30], посвященное равновесиям в системах типа газ - твердое вещество при 600° С; статью Эйгстера и Уонза [9] по устойчивым соотношениям аннита; эти авторы контролировали состав железосодержащих фаз "буферированном" системы парами таких минералов, для которых были известны равновесные парциальные давления Кислорода при данной температуре; и, наконец, работу Холланда [25], в которой рассматривается вопрос об оценке газового давления посредством анализа типичных минеральных ассоциаций.
Перед исследователями
рудных месторождений давно стоит проблема определения состава
рудообразующих флюидов. Судя по огромной массе накопленных данных, нам
нужно предсказывать состав вод по характеру минеральных ассоциаций при
низких температурах. Однако, чтобы достичь сопоставимых результатов для
высоких температур, требуется проведение обширных экспериментальных
исследований. Имеются некоторые основания предполагать, что химия водных
растворов при 400° С окажется менее сложной, чем при 25° С.
1. В a a s Becking L. G. М., К а р 1 a n I. R., М о о re
D. Journ. GeoL, 68, 243, 1960.
2. В a r n е s Н. L., H e 1 g e s о n Н.
С. Tonization constants in aqueous solution, Handbook of Physical
Constants, Clark S. P. (ed.), Geol. Soc. Am. Spec. Paper 36.
3. В a r n
e s H. L., К u 11 e г u d G. Econ. Geol., 56, 648, 1961.
4. B a r t o n
Р. В., J r. Econ. Geol., 52, 333,1957. (Есть русский перевод: Б а р т о н
П. Некоторые пределы возможного состава рудообразующих растворов. Сб.
"Термодинамика геохимических процессов", М., ИЛ, 9-33, 1960.)
5. С а г
г о 1 1 D. Geochim. et Cosmochim. Acta, 14, 1, 1958.
6. С a s t а г о
J. R., G а г г е 1 s R. М. Econ. Geol., 45, 755, 1950.
7. С о 1 е m а n
R.G., D e l e v e a u x М. Econ. Geol., 52, 499, 1957.
8. E m e r y К.
О., R i 11 e n b e r g S. C. Early diagenesis of California basin
sediments, Bull. Am. Assoc. Petrol. Geol., 36, 735, 1952.
9. E u g s t
e г H. P., W о n e s D. R. Journ. Petrology, 3, 82, 1962.
10. E v a n s
H. Т., J г., G а г г е 1 s R. М. Geochim. et Cosmochim. Acta, 15, 131,
1958.
11. F i s с h e г R. P. Vanadium deposit of Colorado and Utah,
U.S. Geol. Surv. Bull., 936-P, 363, 1942.
12. F r o n d e l C., I t o
J. Am. Mineral., 42, 743, 1957.
13. G a r r е 1 s R. М. Am. Mineral.,
38, 1251, 1953.
14. G a r r e 1 s R. М. Geochim. et Cosmochim. Acta, 5,
153, 1953. (Есть русский перевод: Г а р р е л с P.M. Минеральные виды как
функция рН и окислительно-восстановительных потенциалов, особенно в зонах
окисления и вторичного обогащения сульфидных минералов. Сб. "Термодинамика
геохимических процессов", М., ИЛ, 245-246, 1960.)
15. G а г г е 1 s
R.M. Am. Mineral., 40, 1004, 1955.
16. G a r r e l s R.М. Am. Inst.
Chem. Engrs., Nuclear Eng. and Sci Congr., Preprint 250, 1955.
17. Н е
1 g e s о n Н. С. Complexing and Hydrothermal Ore Deposition, New York,
Pergamon, 1964.
18. H e m J. D, Restraints on dissolved ferrous iron
imposed by bicarbonate, redox potential, and рН, U.S. Geol. Surv.
Water-Supply Paper 1459-B, 33-35, I960.
19. H e m J. D. Some chemical
relationships among sulfur species and dissolved, ferrous iron, U.S. Geol.
Surv. Water-Supply Paper 1459-C, 57-73, 1960.
20. H e m I. D. Complexes
of ferrous iron with tannic acid, U.S. Geol. Surv. Water-Supply Paper
1459-D, 75-94, 1960.
21. Н е m J.D., C r o p p e r W.H. A survey of
ferrous-ferric chemical equilibria and redox potentials, U.S. Geol. Surv.
Water-Supply Paper 1459-A, 1-31, 1959.
22. Н е m J. D., S k o u g s t a
d M.W. Coprecipitation effects in solutions containing ferrous, ferric,
and cupric ions, U.S. Geol. Surv. Water-Supply Paper 1459-E, 95-110,
1960.
23. Не m 1 е у J. J. Some mineralogical equilibria in the system
K2O - Al2O3 - SiO2 -
H2O, Am. Journ. Sci., 257, 241, 1959.
24. Н е m 1 е у J. J.,
М е у е г С., R i с h t e r D. H. Some alteration reactions in the system
Na2O - Al2O3 - SiO2 -
H2O, U.S. Geol. Surv. Prof. Paper 424-D, 338, 1961.
25. Н о
1 1 a n d H. D. Econ. Geol., 54, 184, 1959.
26. Н о s t e 11 e r P. В.,
G a r r е 1 s В. М. Econ. Geol., 57, 137, 1962.
27. Н u b е г N. К., G
а r r е 1 s R. М. Econ. Geol., 48, 337, 1953. (Есть русский перевод: Х у б
е р Н.К., Г а р р е л с P.M. Связь образования осадочных минералов слюды с
рН и окислительным потенциалом. Сб. "Термодинамика геохимических
процессов", М., ИЛ, 1960.)
28. J а m е s H. L. Econ. Geol., 49, 235,
1954.
29. К е 1 1 у W. С., С 1 о k e P. L. Mich. Acad. Sci., Arts, and
Letters, 46, 19, 1961.
30. K r a u s k o p f К. В. Econ. Geol., 50th
Anniv. Volume, 411, 1955. (Есть русский перевод: К р а у с к о п ф К. Б.
Осадочные месторождения редких металлов. Сб. "Проблемы рудных
месторождений", М., ИЛ, 1958.)
31. K r a u s k o p f К. В. Geochim. et
Cosmochim. Acta, 12, 61, 1957. (Есть русский перевод: К р а у с к о п ф К.
Б. Содержание тяжелых металлов в магматическом паре при 600°С. Сб.
"Проблемы эндогенных месторождений", М., ИЛ,139-178, 1960.)
32. K r u m
b e i n W. С., G a r r e l s R. М. Journ. Geol., 60, 1, 1952. (Есть
русский перевод: К р а м б е й н В., Г а р р е л с P.M. Происхождение и
классификация химических осадков в зависимости от рН и
окислительно-восстановительных потенциалов, Сб. "Термодинамика
геохимических процессов", М., ИЛ, 73-121, 1960.)
33. M a r c h a n d i
s e H. Symposium Sobre Yacimientos de Manganese, XX Intern. Geol. Congr.
Mexico, 1, 107, 1956.
34. S a t о М. Econ. Geol., 55, 928, 1960.
35.
S t u m m W., L e e G. F. Schweizerisofte Zeits. fur Hydrologie, 22, 295,
1960.
36. Т е о д о р о в и ч Г. И. Сидеритовая геохимическая фация
морей и вообще соленых вод как нефтепроиаводящая. Докл. АН СССР, нов.
сер., 69, № 2, 277, 1949.
37. W h i t e D.A. The stratigraphy and
structure of the Mesabi Range, Univ. of Minnesota, Minnesota Geol. Surv.
Bull., 38, 1954.
|
|
|
|
[Содержание] [Глава 10] [Приложение 1] |