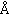 =
10-8см). Ионы, помещенные в таблице в одном горизонтальном
ряду, имеют одинаковое электронное строение
=
10-8см). Ионы, помещенные в таблице в одном горизонтальном
ряду, имеют одинаковое электронное строение| Р.М. Гаррелс, Ч.Л. Крайст | Растворы, минералы, равновесия |
|
|
|
|
|
|
Приводимый ниже список
значений ионных радиусов 1,2) (стр.362) рассчитан
для ионов в шестерной координации (структура NaCl); эти значения даны в
ангстремах (1 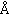 =
10-8см). Ионы, помещенные в таблице в одном горизонтальном
ряду, имеют одинаковое электронное строение
=
10-8см). Ионы, помещенные в таблице в одном горизонтальном
ряду, имеют одинаковое электронное строение
| Li+ 0,60 |
Ве2+ 0,31 |
B3+ 0,20 |
Н- 2,08 |
|
| Na+ 0,95 |
Mg2+ 0,65 |
А13+ 0,50 |
F- 1,36 |
O2- 1,40 |
| К+(1) 1,33 |
Са2+(2) 0,99 |
Sc3+(3) 0,81 |
Сl- 1,81 |
S2- 1,84 |
| Cu+ 0,96 |
Zn2+ 0,74 |
Ga3+ 0,62 |
||
| Rb+ 1,48 |
Sr2+ 1,13 |
Y3+ 0,93 |
Br- 1,95 |
Se2- 1,98 |
| Ag+ 1,26 |
Cd2+ 0,97(4) |
In3+ 0,81 |
||
| Cs+ 1,69 |
Ва2+ 1,35 |
La3+(5) 1,15 |
I- 2,16 |
Те2- 2,21 |
| Au+(6) 1,37 |
Hg2+ 1,10 |
Тl3+ 0,95 |
(1) NH+4, 1,48 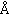 .
.
(2) Mn2+, 0,80;
Fe2+, 0,76; Со2+, 0,74; Ni2+, 0,72 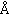 .
.
(3) Ti3+, 0,74;
V3+, 0,74; Сr3+, 0,69; Mn3+, 0,66;
Fe3+, 0,64 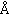 .
.
(4) Sn2+, 1,12
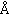 .
.
(5) Ионы трехвалентных
редких земель 1,11 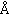 (Се3+) до 0,93
(Се3+) до 0,93 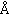 (Lu3+).
(Lu3+).
(6) Тl+, 1,40.
|
1 (стр.362) По Л. Полингу [The Nature of the Chemical Bond, 3rd ed., Cornell University Press, 19 гл. 13]. 2 (стр.362) Здесь не приводятся данные для ионов с окислительным состоянием выше 3+, хотя в работе Полинга эти сведения имеются. |
|
|
|