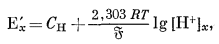
| Р.М. Гаррелс, Ч.Л. Крайст | Растворы, минералы, равновесия |
|
|
|
|
[Содержание] [Глава 4] [Глава 6] |
|
|
|
|
Во многих разделах химии и биологии широко используются значения Eh и рН, измерение которых в настоящее время не вызывает никаких затруднений. Метод с использованием Eh и рН в качестве характеристических переменных позволяет строить весьма удобные диаграммы устойчивости минералов при описании реакций с участием растворенных компонентов. Построению диаграмм Eh - рН с целью изображения соотношений устойчивости минералов посвящена гл. 7. Измерения Eh и рН иногда предпринимаются при качественном или полуколичественном исследованиях некоторых более сложных геохимических систем.
Теория и практика измерений рН подробно изложена в отличных работах Бейтса [I], Голда [6] и Маттока [16]. Несколько более специально вопрос разобран в книге под редакцией Вулмера [24], но для нас эта работа представляет значительный интерес в связи с тем, что в ней рассматривается проблема электродных измерений РCO2 и РO2. Описание эталонных электродов всех типов можно найти в работе Айвеса и Янца [9]. В книге Кларка [3] рассмотрена теория и практика измерений не только рН, но и Eh. Для овладения основами теоретической электрохимии рекомендуем обратиться к книге Глесстона [5, особенно гл. 8].
Ниже мы дадим определение
понятий Eh и рН и свяжем их с практическим способом измерения этих
величин; на практическую сторону методики измерений мы вообще обратим
особое внимание и расскажем о мерах предосторожности, которые надо
соблюдать при исследовании природных геологических сред.
Определение рН было дано ранее в гл. 1. Величина рН вычисляется по уравнению (1.15), которое воспроизводится здесь еще раз:
| pH = - lg[H+]. | (5.1) |
Такой способ определения чрезвычайно прост и ясен, но он совершенно формален, поскольку учитывает активность только одного иона, концентрация которого не может быть непосредственно измерена. Существует другое определение рН, связанное с техникой проведения измерений; к изложению этого вопроса мы и перейдем.
В настоящее время измерение рН осуществляется почти исключительно с помощью гальванического элемента, который состоит из стеклянного электрода, погружаемого в испытуемый раствор и соединенного в замкнутую цепь с эталонным электродом. Эталонным электродом обычно служит ртутно-каломельный электрод (каломель - хлорид ртути), находящийся в насыщенном растворе КСl. Этот раствор связан с испытуемым раствором солевым мостиком из насыщенного раствора КСl. Стеклянный электрод представляет собой колбочку из специального стекла, наполненную кислым раствором; туда помещается внутренний электрод с постоянным напряжением (обычно Ag - AgCl), который осуществляет обратимый обмен электронами с этим раствором. Когда такая колбочка погружается в какой-либо раствор, между внутренним и внешним растворами создается электрический потенциал, который пропорционален логарифму [Н+] во внешнем, испытуемом растворе. Таким образом, эталонный электрод обладает постоянным потенциалом, а потенциал стеклянного электрода будет меняться в зависимости от активности водородных ионов. В связи с этим снимаемое напряжение является функцией активности ионов водорода. Формула подобного элемента может быть изображена следующим образом:
| Стеклянный электрод, раств. x |КСl (насыщ), Hg2Cl2 (тв); Hg (жидк). | (5.2) |
Теория стеклянного электрода более подробно будет рассмотрена в гл. 8. Анализ уравнения (8.66а) показывает, что потенциал полуэлемента стеклянного электрода, чувствительного к водородному иону, для раствора с активностью водородного иона [Н+]x определяется следующим выражением:
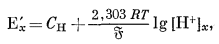 |
(5.3) |
или
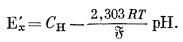 |
(5.4) |
Полный потенциал элемента (5.2) определяется по разности потенциалов двух полу элементов:
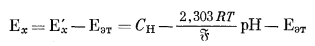 |
(5.5) |
(здесь мы пренебрегаем "потенциалом жидкого соединения"; этот вопрос будет рассмотрен ниже). Далее если данную экспериментальную установку, собранную по схеме элемента (5.2), сначала использовать для определения э.д.с., развиваемой раствором, у которого требуется измерить рН, а затем испытуемый раствор заменить стандартным эталонным раствором с определенной величиной рН и вновь измерить э. д. с. (при той же температуре), то мы будем иметь
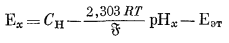 |
(5.6) |
и
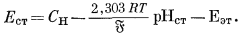 |
(5.7) |
Вычтем из уравнения (5.6) уравнение (5.7) и после небольшого преобразования получим
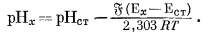 |
(5.8) |
Уравнение (5.8) является основой современного практического определения рН.
При выводе уравнения (5.8)
мы пренебрегли одной особенностью, присущей всем гальваническим элементам
типа (5.2). Обратите внимание, что в формуле элемента (5.2) между (раств.
x) и KCl (насыщ) проведена вертикальная черта. Она обозначает
"потенциал жидкого соединения", т. е. потенциал, возникающий на контактной
поверхности двух различных растворов, например растворов различных
электролитов или растворов различной концентрапии одного и того же
электролита. Применение солевого мостика с насыщенным раствором КС1
снижает этот потенциал до минимума. Если испытуемый и стандартный растворы
близки по составу и концентрации, то потенциал жидкого соединения будет
одинаков для каждого из них и, таким образом, сократится, а уравнение
(5.8) останется в том виде, в каком оно было написано.
Национальное бюро стандартов США производит установленные образцы буферных веществ, из которых можно приготовить стандартные эталонные растворы с воспроизводимой и вполне определенной величиной рН. В свою очередь фирмы, производящие оборудование для измерения рН, выпускают концентрированные растворы этих стандартных веществ; такие растворы перед употреблением достаточно лишь разбавить. Величины рН, установленные для семи эталонных растворов в интервале температур от 0 до 95°С, приведены в приложении 5.
Значения рН этих эталонных
растворов определены на основании измерения э. д. с. элементов, обладающих
ничтожным потенциалом жидкого соединения. В схеме таких элементов
участвуют хлоридные ионы, а точность величины рН, приписываемая данному
эталонному раствору, в конечном счете основывается на принятом условии,
согласно которому она связывается с величиной gCl- в растворе низкой ионной силы и
бесконечно разбавленном в отношении хлоридного иона. Шкала активности
водородного иона, также устанавливаемая этими стандартными растворами,
называется условной шкалой активности.
Данные измерения рН во многих случаях полезны и без пересчета их на активность водородного иона. Однако для большинства физико-химических расчетов данные измерения рН имеют смысл лишь в том случае, когда они в точности соответствуют уравнению (5.1). Другими словами, нас интересуют не данные измерения рН как таковые, а действительные величины [Н+]. Из уравнения (5.8) следует, что рНx можно приравнять к -lg [Н]x, но для этого необходимо научиться выражать рНст через [Н]ст. Считается, что рН эталонных растворов Национального бюро стандартов США соответствует теоретической величине [Н+] с точностью до ±0,01 рН. Кроме того, данные экспериментального измерения рНx по величине рНст могут содержать ошибку, возрастающую с увеличением разницы между потенциалом жидкого соединения при измерениях испытуемого и стандартного растворов. Чем ближе испытуемый и стандартный растворы по своему составу и концентрации, тем меньше величина возможной ошибки.
Трудно высказать какие-либо общие суждения относительно абсолютного размера ошибок за счет потенциала жидкого соединения, которые могут встретиться при измерении рН. Если рН испытуемого и стандартного растворов колеблются от 2 до 12, а испытуемый раствор является водным с ионной силой от 0,01 до 0,1 и не содержит коллоидных и взвешенных частиц, то ошибка, связанная с потенциалом жидкого соединения, будет ничтожной. Ожидаемая общая ошибка измерения рН большинства разбавленных или умеренно концентрированных водных растворов скорее всего находится в пределах от ±0,02 рН примерно до ±0,04 рН. Естественно, оценивать ошибку можно лишь для каждого данного случая. Более подробно этот вопрос рассмотрен в работах Бейтса [I], Голда [б], Маттока [16], Вулмера [24], Айвеса и Янца [9] и Глесстона [5].
Все вышеизложенное совершенно ясно указывает, что под
точностью измерения рН мы подразумеваем возможность перевода данных этого
измерения в единицы активности водородного иона. Таким образом, точность
измерения противопоставляется воспроизводимости, или правильности,
измерения. В настоящее время выпускается самое различное оборудование для
производства определений рН: от карманного прибора с минимальным делением
шкалы рН, равным 0,1, до сложнейших лабораторных установок, способных
давать результаты со средним отклонением повторных измерений ±0,0004 рН
при чрезвычайно точно контролируемых условиях.
Теория стеклянного электрода как прибора, чувствительного к изменению рН, излагается в гл. 8. Здесь мы затронем лишь некоторые ее практические аспекты. Существуют стеклянные электроды самой разнообразной формы и размеров. Электроды "общего пользования" наиболее эффективны при определении рН в пределах от 0 до 11. Для измерения более высоких рН при точных исследованиях необходимо применять специальные электроды "высоких рН". В растворах с высоким рН активность водородных ионов настолько мала, а активность ионов щелочных металлов (или щелочных земель) так высока, что последние ионы начинают влиять на электроды "обычных рН". На этот случай обычным электродам придаются таблицы поправок, но лучше все же использовать специальные электроды. К счастью, рН почти всех природных растворов не превышает 11.
Хотя разные стеклянные электроды показывают одинаковое изменение э. д. с. при данном изменении рН (при одинаковой температуре), редко два электрода дают одинаковое значение э. д. с. для одного и того же раствора. Следовательно, каждый стеклянный электрод нужно калибровать отдельно с помощью стандартных буферных растворов. В обычной практике .электроды. калибруют по одному буферному раствору, рH которого в большинстве случаев равен 7. Однако из предыдущего раздела о точности измерения рН следует, что рH стандартизованного раствора должен быть близок к рН испытуемого раствора, раз уж мы хотим получить точные результаты. Далее из уравнения (5.7) видно, что теоретический наклон линии, отражающей э. д. с. стеклянного электрода (измеряемую относительно эталонного электрода), по отношению к оси рН составляет -(2,303 RТ); математически эта зависимость выражается следующим образом:
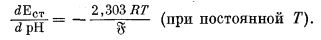 |
(5.9) |
При 25°С1 (стр.116).
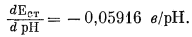 |
(5.10) |
Наклон этой линии можно
установить посредством измерения э. д. с. относительно двух, а еще лучше
трех различных буферных растворов. По результатам этих, наблюдений можно
вообще оценить работу всей установки. Подобную калибровку наклона линии
э.д.с./рН следует проводить для каждого нового стеклянного электрода, а к
проверке наклона линии время от времени нужно возвращаться в течение всего
периода производства измерений на незнакомых растворах. Если требуется
высокая точность, рекомендуется подбирать такие стандартные растворы, рН
которых немного отличались бы один от другого и вместе с тем находились бы
по разные стороны от измеряемых величин рН.
|
1 (стр.116) О величине отношения (2,303 RT)/Б см. в гл. 1; таблицы численных значений этого отношения в зависимости от температуры имеются в работах Маттока [16, стр. 395] в Бейтса [1, стр. 313]. |
При измерении рН в сочетании со стеклянным электродом могут быть использованы самые различные электроды. Главное требование, предъявляемое к эталонным электродам, определяется тем, чтобы они обеспечивали постоянную э. д. с. при данной температуре. В последнее время наиболее широко применяется насыщенный каломельный электрод. Он состоит из ртути, соприкасающейся с каломелью, которая в свою очередь контактирует с насыщенным раствором хлористого калия. Полуэлементная реакция этого электрода выражается следующим уравнением:
| 2Hgжидк + 2Cl-водн = Hg2Cl2 крист + 2e. | (5.11) |
Потенциал этой реакции составит
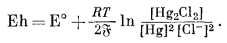 |
(5.12) |
Активности Hg2Cl2 и Hg постоянны и равны единице (при давлении 1 атм), а поскольку раствор КСl находится в равновесии с твердым KCl, активность иона Сl- также будет постоянна. Поэтому уравнение (5.12) упрощается :
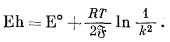 |
(5.13) |
При 25° С Eh насыщенного каломельного электрода характеризуется положительной величиной 0,2444 в, измеренной относительно стандартного водородного электрода. Точные значения потенциала каломельного электрода при различных температурах приведены в работе Айвеса и Янца [9, стр. 161]. При сопоставлении этих значений для температур, близких к 25° С, обнаруживается следующая приближенная зависимость;
| Eh = 0,2444 - 0,00066(t - 25)в | (5.14) |
(t означает температуру в градусах Цельсия). Для излагаемого здесь метода измерения рН по уравнению (5.8) не обязательно знать численную величину потенциала каломельного электрода; она нам потребуется лишь при измерениях Eh.
На практике каломельный электрод соединяется с испытуемым раствором с помощью различных приспособлений. Некоторые электроды предназначены для непосредственного погружения в раствор - они снабжены асбестовой нитью или керамической пробкой, запаянными в донной части электрода. Такая нить или пробка насыщаются раствором КСl, и ионы К+ и Сl-обеспечивают необходимую электрическую связь с испытуемым раствором. В других случаях отверстие в стенке электрода затыкается втулкой из стекла с матовой поверхностью; здесь соединение с раствором создается благодаря тонкой пленке раствора КСl между втулкой и стенкой электрода. Каломельные электроды прочих типов не помещаются в испытуемый раствор, а связь с ним осуществляется через солевой мостик. Наиболее часто используются электроды, предназначенные для погружения в испытуемый раствор, в связи с чем в него неизбежно будут диффундировать небольшие количества КСl. Поэтому измерение рН растворов, которые содержат компоненты, чувствительные к ионам К+ и Сl-, может оказаться неточным. В данном случае рекомендуется использовать солевой мостик с неактивным электролитом.
Если же электрод погрузить
в раствор на несколько часов или дней, то раствор значительно загрязнится
хлористым калием, а диффузия ионов раствора в электрод может вызвать
изменение его э. д. с. Поэтому следует взять себе за правило менять
раствор КСl в электроде примерно через каждые 24 час его работы.
При использовании аппаратурой, предназначенной для измерения рН, следует руководствоваться специальными инструкциями, которые прилагаются к каждому прибору. Однако нелишне сделать некоторые общие замечания о мерах предосторожности при производстве измерений, особенно в полевых условиях.
Поскольку стеклянный электрод обладает высоким сопротивлением, э.д. с. между стеклянным и каломельным электродами измеряется с помощью "рН-потенциометра" (гальванометра) с большим полным сопротивлением. В связи с высокой чувствительностью аппаратуры провода, подсоединяющие стеклянный электрод покрываются металлической оболочкой. Это делается с той целью, чтобы обеспечить необходимую защиту от блуждающих электрических полей или емкостного эффекта, создаваемого самим прибором, т. е. от явлений, приводящих к ошибочным результатам определения рН. Так как при производстве измерений в полевых условиях требуются стеклянные электроды на длинных проводах, необходимо внимательно следить за сохранностью защитной изоляции по всей их длине.
Следует постоянно учитывать роль температуры. рН-потенциометр нужно калибровать на буферных растворах при той же температуре, которую имеет испытуемый раствор. Пользоваться можно только тем значением стандартного эталонного буфера, которое характеризует его при температуре измерения. В большинстве приборов есть "температурные компенсаторы", которые можно настроить на температуру испытуемого раствора. При такой регулировке в рН-потенциометре устанавливается правильный наклон линии уравнения (5.7), т. е. отношения (2,303 RT)/Б.
Некоторые электроды в измерительной системе, стандартные элементы в потенциометре и съемные батареи питания меняют свою э.д.с. в зависимости от температуры. В результате этого нуль обычных рН-потенциометров смещается, но до каждого отсчета и после него такое смещение следует проверять и при необходимости производить установку нуля. Все это особенно важно при внелабораторных исследованиях. В высокогорной местности, например, ранним утром отсчеты могут производиться при температуре прибора 10° С, тогда как в середине дня температура прибора может повыситься до 40° С. Такое изменение условий существенно влияет на работу батареи и усилителя; если частота проверки установки нуля недостаточна, то ошибки в определении рН могут достигать 0,5 единицы. В случае подобных изменений температуры следует обратить внимание и на возможное изменение температуры испытуемого раствора и, если необходимо, заново провести калибровку рН-потенциометра при новой температуре.
Вообще на гомогенные
растворы электрод реагирует быстро, но для удаления адсорбированных ионов
между каждыми двумя измерениями его следует несколько раз промыть
дистиллированной водой. Поскольку равновесие достигается при постепенном
уменьшении скорости изменения рН на шкале прибора, отсчеты следует
производить через равные промежутки времени до тех пор, пока смещение
стрелки не прекратится. Небольшое откло-нение стрелки со временем нельзя
принимать за приближение к окончательному показанию; в подавляющем
большинстве случаев электроды вначале быстро реагируют на новую среду, а
затем происходит медленное равномерное изменение показателя рН на довольно
большом интервале, продолжающееся до тех пор, пока неустановится
окончательное равновесие электрода с испытуемым раствором.
1
Отдельные модели приборов обеспечивают "буферный компенсационный"
контроль, что разрешает пользоваться буферными растворами при
температурах, отличных от температуры измерения (конечно, в ограниченном
температурном интервале).
Основная трудность получения удовлетворительных результатов при измерении рН в природных средах связана с тем, что введение электрода в данную среду может вызвать существенное ее изменение. Хорошие результаты можно получить для вод с открытой поверхностью, например для рек, озер, морей, которые уже длительное время находятся в контакте с атмосферой. Но среды, закрытые по отношению к атмосфере, исследовать трудно в связи с возможным их загрязнением во время или после погружения в них электродов. Ввод электродов, как правило, либо сопровождается привносом в испытуемую среду газов, либо, наоборот, способствует их удалению.
Пока еще мало сделано в направлении конструирования специальных электродов и приспособлений, предназначенных для измерения рН природных вод in situ. B настоящее время имеется определенная тенденция подносить воду к прибору, что обычно приводит к взаимодействию ее с атмосферой. В результате показания прибора равномерно изменяются, и оператор оказывается в незавидном положении, пытаясь отгадать, каким бы был отсчет, не будь этого взаимодействия. Кроме того, практика переноса пробы воды к потенциометру влечет за собой изменение ее температуры, что также способствует приобретению или потере водой летучих. К числу важнейших летучих компонентов в водах относятся углекислый газ и сероводород, которые обладают способностью входить в систему и оказывать влияние на ее рН. В связи с этим необходимо прибегать к чрезвычайным мерам предосторожности, чтобы сохранить первичный состав вод как во время взятия пробы, так и в процессе самого измерения.
Затруднения, связанные с опробованием гомогенных растворов, ничтожны по сравнению с трудностями, которые возникают при измерении и интерпретации результатов определения рН минеральных суспензий или поровых вод в горных породах. В частности, показания рН для взмученной суспензии могут отличаться от значений рН жидкости после отстаивания. Это свидетельствует о воздействии на электроды взвешенных частиц с адсорбированными водородными ионами.. Такое явление было специально изучено Хаусером и Ридом [8] при исследовании катионообменной способности почв. Электроды "видят" только свое непосредственное окружение, и поэтому измерение рН следует вести с максимальной тщательностью: только в этом случае можно быть уверенным, что электроды окружены именно той средой, которую оператор хочет измерить. Некоторые исследователи пытаются использовать измерения рН в илах и других подобных средах для химических расчетов, справедливых только в отношении гомогенных растворов; получаемые таким образом результаты представляются весьма и весьма сомнительными.
В литературе опубликованы
немногочисленные определения "почвенных рН". Обычно их получают следующим
образом: приготавливают суспензию из определенных весовых количеств
отобранной почвы и воды, а затем замеряют рН жидкой смеси. Такие
результаты могут быть использованы только для качественной характеристики,
так как они определяют сумму водородных ионов в исходной воде плюс
водородные ионы, освобождаемые почвенными частицами, и плюс влияние на
электроды почвенных коллоидов 1 (стр.119).
|
1 (стр.119) На существенное понижение величины рН в осадке по сравнению с раствором, из которого выпал этот осадок, обратил внимание Матток [16, стр. 172-173]. Вопрос о причине и значимости "суспензионного эффекта" был темой оживленной дискуссии; судя по всему, природа этого эффекта еще не установлена. Однако известно, что, если суспензированный материал представлен агрегированными частицами (как в случае многих глин), суспензионный эффект не обнаруживается. Он становится весьма существенным в кислых растворах или в том случае, если взвешенные частицы имеют коллоидальный характер и несут сильный заряд. |
Если испытуемая суспензия находится в контакте с атмосферой и частицы почвы заимствуют водородные ионы из добавленной воды, то начальная реакция может дать высокое значение рН с последующим постепенным понижением его по мере абсорбции CO2. Хорошие примеры подобных изменений наблюдаются при работе с щелочными средами, что можно проиллюстрировать следующим экспериментом. Если избыток тонко измельченного кальцита поместить в деаэрированную воду, величина рН в растворе над осадком составит примерно 9,9, но если к этой системе открыть доступ воздуха, начнется снижение величины рН и окончательное равновесие установится при рН, равном 8,4. Иначе говоря, разница значений рН для данной системы в контакте с атмосферой и в отсутствие такого контакта составляет 1,5 единицы.
Интересное исследование по определению рН в почвах и озерных илах проделал Горэм [7]. Первое измерение рН он производил путем непосредственного погружения электрода в испытуемую среду, затем отжимал из почвы воду и измерял ее рН до аэрации и, наконец, пропускал через отжатую воду воздух и производил третий замер рН. Результаты его измерений приводятся в табл. 5.1. Низкие величины рН были получены при непосредственном вводе электрода в среду: они обусловлены суспензионным эффектом.
Таблица 5,1
| Определение рН стеклянным электродом | |||
| при непо- средственном погружении |
на отжатом растворе |
на аэриро- ванном растворе | |
| Плотный покров гумуса над почвой (тог) | 3,5 | 3,9 | 3,9 |
| 3,4 | 4,1 | 4,1 | |
| 3,4 | 4,3 | 4,3 | |
| 3,5 | 4,5 | 4,5 | |
| 3,3 | 4,6 | 4,8 | |
| Гумус, перемешанный с минеральными вещест | 4,6 | 5,9 | 6,5 |
| вами (mull) | 5,3 | 6,0 | 6,6 |
| 5,4 | 6,2 | 7,1 | |
| 5,7 | 6,5 | 7,3 | |
| 5,4 | 6,6 | 7,1 | |
| Озерные илы1 (стр.120) | |||
| Глубина в сантиметрах | |||
| 20-40 | 6,5 | 6,8 | 8,1 |
| 80-100 | 6,4 | 6,8 | 8,5 |
| 100-120 | 6,3 | 6,6 | 8,4 |
| 160-180 | 6,3 | 6,8 | 8,0 |
| 220-240 | 6,2 | 6,7 | 8,0 |
| 250-270 | 6,2 | 6,8 | 8,3 |
| 290-310 | 6,3 | 7,0 | 8,4 |
| 340-360 | 6,3 | 6,8 | 8,2 |
| 385-4052 (стр.120) | 6,6 | 6,6 | 7,1 |
|
1 (стр.120) рН воды над слоем ила равен 6,8; после аэрации повышается до 7,6. 2 (стр.120) Ил теряет органическое вещество и становится глиноподобным. |
Высокие значения рН характеризуют аэрированную воду, что связано с потерей СО2 при установлении равновесия с атмосферой. Здесь может возникнуть вопрос: не является ли причиной расхождения между значениями рН, определенными при прямом погружении электрода и для свежеотжатой воды из озерных илов, частичная аэрация пробы? В результате измерений, проведенных Сивером с соавторами [20] для морских осадков, было установлено, что величины рН, определяемые путем непосредственного ввода электродов в свежую, только что поднятую со дна пробу, находятся в пределах от 7,4 до 7,8, тогда как рН вод, отжатых из этих проб, характеризуется значениями от 8,1 до 8,2. Однако в тех случаях, когда воды отжимались в атмосфере азота, их рН оказывался равным рН тех же проб, полученному при непосредственном вводе электрода (Сивер, личное сообщение). Этот факт свидетельствует о том, что при отжимании воды из пробы на воздухе происходит аэрация, приводящая к потере СО2. В настоящее время мы близки к выводу, что удовлетворительные результаты измерения рН поровых вод получаются при непосредственном вводе электродов в среду; исключение из этого правила составляют кислые среды, для которых суспензионный эффект может оказаться существенным.
Чрезвычайно полезный прибор - так называемый карбонатный сатуро-метр - недавно сконструирован Уэйлом [23]. Главными составными частями этого прибора являются рН-электрод, эталонный электрод и портативный милливольтный гальванометр с высоким полным сопротивлением. Гальванический элемент устроен таким образом, что в непосредственной близости от измерительного электрода можно помещать тонкоизмельченный карбонат.
Принцип действия этого
прибора определяется тем, что рН водного раствора при растворении или
осаждении карбоната изменяется. Таким образом, если вводить измельченный
карбонат в раствор, недосыщенный относительно этого карбоната, в системе
будет происходить смещение в сторону установления равновесия и активность
водородных ионов понизится. Если же раствор пересыщен, то произойдет
осаждение карбоната, а ионы Н+ будут освобождаться. Уэйл
разработал теорию карбонатного сатурометра, и теперь этот прибор можно
калибровать для любого данного карбоната в растворах самых различных
типов. Используя свой прибор при исследовании искусственной морской воды,
Уэйл установил, что ее рН колеблется в пределах от 7,5 до 8,3; при этом
была достигнута чувствительность 1 мв при изменении концентрации
кальцита на одну миллионную долю.
В гл. 1 окислительный потенциал Eh определялся как потенциал полуэлемента, измеренный по отношению к стандартному водородному полуэлементу, причем э. д. с. стандартного водородного элемента при всех температурах считалась равной нулю. Там же рассматривались соотношения между Eh, E°, DF, DF°, константой равновесия К и квотантом реакции Q.
Чтобы избежать путаницы в определении знака потенциала данного полуэлемента относительно водородного полуэлемента, следует принять ряд дополнительных условий. Эти условия прежде всего касаются порядка написания реакций полуэлементов и знака, проставляемого в формуле между DF и nEБ. В настоящей книге принят такой способ составления уравнений реакции полуэлемента, когда часть уравнения, отражающего реакции с выделяющимися электронами, помещается справа. Так, например, для реакции образования Zn2+водн из металлического цинка мы принимаем такую запись:
| Zn = Zn2+водн + 2e | (5.15) |
В гл. 1 мы решили писать следующие соотношения таким образом (и с такими знаками):
DF = +nEБ
DF°+ nE°Б = RT ln K.
На основании этих условий и выводится знак потенциала любого полуэлемента.
Так, для полуреакции (5.15) при 25°С Е° = -0,763 в. Проставленный здесь знак совпадает со знаком, принятым в так называемой европейской системе условных обозначений. Во многих американских изданиях порядок написания уравнений полуреакции тот же, что и у нас [см. уравнение (5.15)], но в формулах знаки таковы:
DF° = - nЕБ = - RТ ln К.
Согласно американской. системе условных обозначений, потенциал полуреакции (5.15) при 25° С равен Е° = + 0,763 в. Итак, по европейской и американской системам обозначений численные величины потенциала полуреакции одинаковы, но знаки противоположны.
Окислительный потенциал измеряется с помощью электродной пары, состоящей из инертного и эталонного электродов. В большинстве случаев при измерении Eh, как и при измерении рН, эталоном служит насыщенный каломельный электрод.
В качестве инертного электрода чаще всего используется гладкий платиновый- электрод, но достаточно широкое применение находит и золотой электрод. Как и в случае измерения рН, роль каломельного электрода заключается в возбуждении известной э. д. с. ив обеспечении электрической связи с испытуемой системой. Инертный электрод действует как поглотитель или источник электронов по отношению к ионам испытуемого раствора. Будучи подсоединен к каломельному электроду, платиновый электрод может получать электроны от растворенных ионных компонентов или же отдавать электроны в зависимости от того, большим или меньшим потенциалом обладают компоненты раствора по сравнению с потенциалом эталонного каломельного электрода.
В качестве примера окислительно-восстановительной системы рассмотрим водный раствор, содержащий ионы Fe2+ и Fe3+ с активностями [Fe2+] = 0,001 и [Fe3+] = 0,01. Предположим, что нам предстоит измерить окислительный потенциал этой системы. Формулу соответствующего гальванического элемента можно изобразить следующим образом:
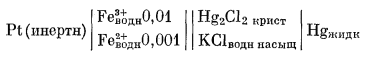 |
(5.16) |
Попытаемся определить э.д.с. элемента (5.16), пользуясь методикой, рассмотренной в гл. 1. Выпишем уравнения обеих полуреакций и дадим обозначения полуэлементных потенциалов:
| 2Fe2+водн = 2Fe3+водн + 2e, EhFe2+,Fe3+, | (5.17) |
| 2Hgжидк + 2Cl-водн = Hg2Cl2 крист + 2е, Ehэт. | (5.18) |
Вычтем уравнение (5.18) из уравнения (5.17) и получим
| 2Fe2+водн + Hg2Cl2 крист = 2Fe3+водн + 2Hgжидк + 2Cl-водн. | (5.19) |
а также
| э.д.с. (5.16) = EhFe2+, Fe3+ - Ehэт. | (5.20) |
Уравнение (5.19) характеризует реакцию всего элемента, а уравнение (5.20) определяет соотношение между потенциалом элемента (5.16), окислительным потенциалом пары Fe2+, Fe3+ и потенциалом эталонного каломельного электрода. Величина Еhэт при данных температуре и давлении постоянна и для насыщенного каломельного электрода при 25° С составляет 0,2444 в, - как это было установлено в разделе об измерении рН. В соответствии с уравнением (1.24а) для полуреакции (5.17) при 25° С мы вправе написать
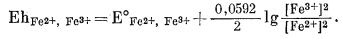
Упрощаем это выражение:
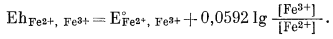 |
(5.21) |
Подставив численные значения Е0Fе2+, Fе3+ и активностей рассматриваемых дюнов, находим
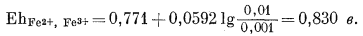 |
(5.22) |
Подставим полученную величину и величину потенциала каломельного электрода в уравнение (5.20):
э.д.с. (5.16) = 0,830 - 0,244 = 0,586 в.
Найденное значение потенциала, равное 0,586 в, и есть та величина, которую мы должны были бы получить при измерении потенциала элемента (5.16) (если пренебречь потенциалом жидкого соединения, который при использовании мостика из насыщенного раствора КСl будет минимальным).
А теперь опишем изложенную выше методику в обобщенном виде. Запись уравнения полуреакции для любой окислительно-восстановительной системы имеет следующий вид:
| Востановленное состояние = окисленное состояние + ne; | (5.23) |
соответствующее ей выражение для потенциала этого полуэлемента выглядит следующим образом:
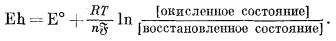 |
(5.24) |
Эталонный электрод действует просто как полуэлемент с постоянным потенциалом (при неизменной температуре), а поэтому э. д. с. всего элемента определяется уравнением
| э.д.с.элемент = Ehвосст.сост, окисл.сост - Ehэт. | (5.25) |
Использование численных
значений, получаемых при измерении Eh, для определения соотношения
активностей ионов по уравнению (5.24) основывается на следующих
предпосылках:
1. Все компоненты, входящие
в рассматриваемую окислительно-восстановительную систему, находятся во
взаимном равновесии; иначе говоря, измеряемая величина э. д. с.
действительно указывает на наличие в системе тенденции к окислению или
восстановлению. Например, предполагается, что при добавлении раствора,
содержащего ионы окисного железа, в раствор с ионами трехвалентного
ванадия произойдет взаимодействие согласно следующему уравнению:
Fe3+ + V3+ + H2O = Fe2+ + VO2+ + 2H+
и что в конечном итоге соотношение ионов станет
равновесным. Вообще говоря, такое предположение справедливо в случае
простых растворенных компонентов, хотя и среди неорганических ионов
имеется немало исключений (они относятся, в частности, к сульфатным и
бисульфатным ионам, а также к растворенному
кислороду).
2. Считается, что платиновые
или золотые электроды действуют как инертные электроды. Однако с
некоторыми растворами платина или золото могут вступать во взаимодействие
и покрываться при этом корочкой нового вещества. В таком случае получаемые
замеры Eh непригодны для каких-либо вычислений, касающихся растворенных
компонентов. Особые погрешности связаны с растворами, содержащими
двухвалентную серу, так как в подобных растворах поведение платинового
электрода может заметно отклоняться от нормы. К счастью, компоненты,
вступающие в реакцию с золотом или платиной, относятся к сильным
окислителям и в природных средах почти не встречаются.
Наилучшие результаты дают платиновые электроды с большой поверхностью, поэтому электроды "наперсточного типа" (thimble type), как правило, следует предпочитать электродам "пуговичного типа" (button type) или простой платиновой проволочке. Как указывалось выше, платиновый электрод может покрываться пленкой в результате реакции с испытуемым раствором или же в связи с выпадением на нем осадка из этого раствора. Для очистки электродов применяются различные методы, но, по-видимому, надежнее всего пользоваться механической очисткой с помощью тонкой наждачной бумаги. Применение сильнодействующих химических средств очистки во многих случаях может просто привести к образованию на платиновом электроде нового реакционного слоя.
Существует возможность приготовления различных окислительно-восстановительных систем с вполне определенным потенциалом; с помощью этих систем и производится проверка платиново-каломельной пары электродов. Излагая результаты своего изучения окислительных потенциалов морских осадков, Зобелл [25] предложил пользоваться раствором 1/300 М ферроцианида калия, 1/300 М феррицианида калия и 1/10 М КСl. По его данным Eh такой системы при 25° С составляет 0,430 в. Для той же цели можно воспользоваться "формальным потенциалом" Свифта [22, стр. 540]. Формальным потенциалом раствора называется экспериментально установленный потенциал раствора, содержащего одновременно окисленные и восстановленные компоненты с 1-формальной концентрацией каждого из них наряду с другими веществами при данной их концентрации. Таблица значений формальных потенциалов имеется в указанной работе Свифта.
При измерении Eh в качестве
эталонного электрода обычно используют насыщенный каломельный электрод;
все сказанное о нем в разделе, посвященном измерениям рН, приложимо и в
данном случае. К этому следует добавить, что при измерении Eh опасность
загрязнения каломельного электрода в связи с диффузией в него испытуемого
раствора еще больше, чем при определениях рН, а поэтому электроды
необходимо очищать через несколько часов работы. Если каломельный электрод
погружается в раствор, температура которого на 5-10° выше первоначальной
температуры электрода, то необходима примерно получасовая выдержка, чтобы
наступило равновесие электрода с раствором.
При обращении с приборами, измеряющими Eh, необходимо следовать тем же мерам предосторожности, которые были указаны для случаев измерения рН. Единственное исключение связано с относительно низким сопротивлением цепи элемента, что допускает менее тщательную изоляцию электродных щупов.
Больше всего трудностей при измерениях Eh возникает из-за загрязнения платинового электрода. Поэтому на практике обычно пользуются двумя такими электродами и меняют их в процессе проведения измерений. Порча платинового электрода, как правило, случайное явление, а поэтому любое случайное отклонение будет выявлено по разнице измеренных потенциалов для двух электродов. Опыт показывает, что даже при самой тщательной работе оба замера будут расходиться самое меньшее на 5 мв, а при повторных измерениях природных сред разница может достигать 10-20 мв.
Наиболее удобный метод измерения Eh и рН состоит в
применении многоканальных самозаписывающих приборов. При пользовании
такими стационарными установками нетрудно достичь хорошего заземления
аппаратуры и растворов, а также обеспечить удовлетворительную защиту
электродных щупов. Наконец, непрерывная запись позволяет наблюдать и
точнее определять скорость изменения показаний прибора в течение
длительного времени.
Число известных определений Eh природных сред резко уступает количеству определений их рН. Имеющиеся в нашем распоряжении данные относительно систем, равновесных с атмосферой, весьма неутешительны, так как они свидетельствуют о небольшом диапазоне значений Eh. Эти определения соответствуют "необратимому кислородному потенциалу", в понимании Меркля [17, стр. 200-218]. Если растворенный кислород принимает участие в равновесной системе, он не влияет на изменение потенциала и ведет себя как очень слабый окислитель. В этом. случае под влиянием растворенного кислорода, по-видимому, происходит медленное окисление растворенных ионных компонентов, характеризующееся низким потенциалом. В результате влияние атмосферного кислорода ограничивается созданием относительно слабого окислительного эффекта (при рН = 0 величина Eh составляет примерно 0,650-0,700 в, а при рН = 8 находится в пределах от 0,300 до 0,350 в). Хотя такое влияние значительно меньше теоретического, пропускание воздуха через систему с первоначально низким Eh вызывает быстрое изменение ее потенциала до "необратимого". Кроме того, растворенный кислород, по-видимому, способен непосредственно воздействовать на платиновый электрод, и поэтому наблюдаемый потенциал аэрированной системы зависит не только от окислительного состояния растворенных компонентов. Короче говоря, потенциалы систем, открытых для воздуха (при 25° С), соответствуют следующему приближенному выражению:
| Eh = 0,70 - 0,06 pH. | (5.26) |
Это равенство не согласуется с расчетными данными для равновесных условий, по которым
| Eh = 1,23 - 0,06 pH. | (5.27) |
Измерение потенциала в природных средах, неравновесных по отношению к воздуху, представляет значительные трудности, поскольку почти невозможно ввести в систему электрод и при этом воспрепятствовать проникновению туда воздуха. Обычная практика переноса проб к приборам еще более непозволительна при определении Eh, чем при определении рН, в связи с быстрым выравнивающим действием атмосферного кислорода. Несмотря на это, тщательно проведенное исследование может дать ценные результаты, что хорошо видно на примере прекрасной работы Старки и Уайта [21], посвященной коррозионным явлениям в аэрированных и увлажненных почвах. Эти авторы сконструировали специальный зонд, который можно было вводить во влажную почву в закрытом виде и уже там открывать его с тем, чтобы электроды, предназначенные для измерения Eh и рН, приходили в соприкосновение с почвой. Некоторые полученные ими данные, сопоставленные со степенью коррозии железа, приведены в табл. 5.2.
Таблица 5.2
| Eh | РН | Степень коррозии железной трубки |
| 0,046 | 6,5 | Корочка FeS, сильная коррозия |
| -0,2931 (стр.126) | 6,7 | Корочка FeS, умеренная коррозия |
| 0,206 | 6,5 | Коррозия не наблюдается |
| 0,370 | 6,2 | Слабая коррозия |
| 0,563 | 7,7 | Коррозия отсутствует |
| 0,544 | 7,6 | Немного окислов железа, слабая коррозия |
|
1 (стр.126)Причина возникновения столь низкого потенциала неясна. |
Большая часть прочих достоверных определений Eh в природных средах выполнена при исследованиях бескислородных донных зон в морях и озерах. Имеющиеся данные свидетельствуют о том, что в этих средах могут создаваться чрезвычайно сильно восстановительные условия; самые низкие потенциалы характерны для вод, содержащих растворенный водород (присутствие газообразного водорода обнаруживается аналитически). Многие определения Eh (как, впрочем, и рН) сделаны для почв и осадков на суспензиях, приготовленных из определенной навески пробы, взмученной в определенном объеме воды. Насколько ценны подобные определения Eh, не установлено. Как свидетельствует большая часть полученных результатов, исследователи, по-видимому, не удаляли воздух из приготовленной суспензии. Если же в ряде определений воздух не попадал в систему (за исключением того воздуха, который уже был в образце почвы или осадка), то показания приборов, возможно, и отражали относительное содержание различных окислительно-восстановительных, пар ионов, растворенных в воде. И уж совсем неясно, отражают ли эти замеры какие-либо соотношения в валовом составе осадка или относятся к поровой воде, первоначально находившейся в контакте с этим осадком.
Определение величины Eh перовых вод, заключенных в горных породах в природных условиях,- это огромная неизученная область. Главные затруднения при проведении исследований здесь вызываются механическими причинами: электроды нужно вводить в испытуемые среды, не допуская привноса инородного материала и не нарушая естественной циркуляции вод. Однако решение данной проблемы могло бы многое рассказать нам о том, как мигрирующие воды теряют кислород и с какой скоростью поровые воды приходят в равновесие с окружающей средой.
Успешное определение величин Eh и рН в зависимости от глубины провел Мангейм [14], исследовавший одну застойную бухту в Балтийском море глубиной около 16 м. Для этого он воспользовался следующим простым методом: в качестве Eh-электрода взял платиновое кольцо, внутрь которого помещалась чувствительная часть стеклянного рН-электрода; защитная оболочка соединительной шейки рН-электрода одновременно служила проводником для платинового электрода. Такой спаренный Eh - рН-электрод подсоединялся к концу одинарного экранированного кабеля. Эталонный электрод оставался над водой; со всей; тщательностью вводились поправки на температуру. Часть результатов, полученных в процессе этого эксперимента, показана на фиг. 5.1.
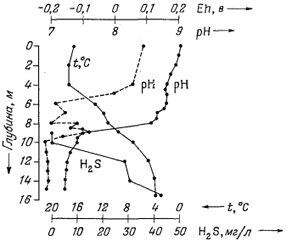 |
| Фиг. 5.1. Зависимость величин Eh и рН (а также концентрации H2S и температуры) от глубины в застойной морской бухте с солоноватой водой [14]. |
Германов с соавторами [4]
провели серию определений Eh и рН подземных вод, фонтанирующих из
подземных и'поверхностных буровых скважин; при этом принимались все
возможные меры предосторожности, чтобы не допустить соприкосновения проб с
воздухом. Эти исследователи установили, что Eh изученных ими сред колеб
лется в пределах от +0,550 до -0,480 в и что полученные результаты
коррелируются с содержанием растворенных в воде газов. Высокие
(положительные) потенциалы были связаны с наличием свободного кислорода, а
низкие, как и следовало ожидать,- преимущественно с присутствием
газообразных углеводородов. В ряде случаев воды, содержащие растворенный
кислород, обнаруживались на глубине до 1000 м ниже уровня грунтовых
вод.
По-видимому, наиболее желательным применением методов измерения э. д. с. .(с помощью соответствующих электродов) для решения геологических задач явилось бы определение активности индивидуальных ионов. В настоящее время: исследователи все большее внимание сосредоточивают на "практических" концепциях и методиках расчетов, которые базируются на непосредственно измеряемых величинах. Поскольку активность отдельного иона нельзя измерить непосредственно, а можно лишь рассчитать по результатам измерений э.д.с., предварительно сделав ряд "сверхтермодинамических" допущений, постольку в последнее время стали отказываться от использования гальванических элементов для вывода даже приближенных значений активности индивидуальных ионов. Конечно, существует несколько способов прямого и достаточно точного измерения средних коэффициентов активности (в том числе и с помощью измерения э. д. с.), на значимость которых указывают при каждом удобном случае. Тем не менее при многих физико-химических расчетах без учета активностей индивидуальных ионов, по-видимому, не обойтись, в связи с чем целесообразно рассмотреть возможность хотя бы приблизительного определения этих величин. Хороший пример, свидетельствующий о необходимости определения активности индивидуальных ионов, будет продемонстрирован при описании ионообменных реакций в гл. 8.
Здесь мы не будем подробно останавливаться на вопросе, почему измерение активности индивидуальных ионов обычно считается невозможным. Чаще всего в качестве теоретического аргумента выдвигается невозможность экспериментального измерения явления, в процессе которого отдельная заряженная частица переходит в раствор или выделяется из него. Это связывается с необходимостью создания сильного электрического поля для отделения достаточного количества ионов от связанных с ними противоположно заряженных частиц.
Оценка преимуществ и недостатков всех возможных электродов не входит в задачу настоящей книги. Однако необходимо отметить, что методы определения активности огромного большинства ионов в их природной среде либо уже разработаны, либо могут быть разработаны. Ниже мы приведем несколько примеров использования таких электродов.
В гл. 8 мы расскажем о недавно сконструированных стеклянных электродах, обладающих избирательной чувствительностью на отдельные катионы. Применение этих приборов создает большие возможности для проведения геохимических исследований. Уже детально изучены электроды, избирательно чувствительные на щелочные ионы и ионы щелочных редких земель. Маршал с сотрудниками [15] для измерения активности ионов щелочных металлов в простых растворах создали электроды иного типа. Эти приборы в общем состоят из концентрационных элементов, в которых инертный электрод погружен непосредственно в раствор щелочной соли. Разница в величинах активности этого раствора с обеих сторон мембраны создает э. д. с., которую можно калибровать в единицах активности данной соли щелочного металла в растворе. Такой прибор в принципе подобен стеклянному электроду. Уравнение, соответствующее элементу этого типа, имеет следующий вид:
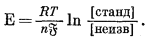 |
(5.28) |
Следовательно, если стандартный раствор при измерении [К+] представлен раствором КСl с известной, относительно низкой ионной силой, которая допускает предположение о равенстве gK+ = gCl-, тo активность K+ в стандартном растворе можно легко вычислить по известным значениям g±KCl: gK+ = g±KCl, аK+ = gK+ * mK+. Уравнение (5.28) принимает вид
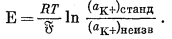 |
(5.29) |
Концентрационные элементы всех видов изучены уже давно; установлено, что их поведение в основном определяется уравнением (5.28). Применение этих элементов с целью определения активности индивидуальных ионов всегда основывается на некоторых эталонах, как это мы и продемонстрировали.
Существует несколько удачных конструкций электродов, предназначенных для измерения активности анионов. Один из них представлен хлоро-серебряным электродом (обычно используемым в качестве эталонного), который можно применять для определения активности иона хлора. Для полуэлементной реакции
Agкрист + Сl-водн = AgСlкрист + е
потенциал составит
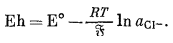 |
(5.30) |
Сходным образом при определении активности ионов Вr- и I- можно воспользоваться электродами Ag - AgBr и Ag - AgI соответственно.
Для измерения активности сульфид-ионов годится серебро-сернистосе-ребряный электрод:
| 2Agкрист + S2-водн = Ag2Sкрист + 2e, | |
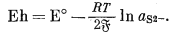 |
(5.30) |
Прочие окисные, кислородные и сульфидные электроды, представляющие значительный потенциальный интерес для геохимиков, подробно рассматриваются Айвесом [9, гл. 7].
В книге Айвеса, в которой
излагается теория окисных и кислородных электродов, можно найти ответ на
вопрос: что же мешает использованию металлических электродов для измерения
активности ионов в природных средах? На большинстве металлов образуется
поверхностная пленка окислов или гидроокислов, которая прекращает действие
электрода "металл - ион металла". В этом случае электрод становится
чувствительным к водородным ионам; действительно, многие пары металл -
окись металла используются в качестве рН-электродов. Другой камень
преткновения заключается в трудности воспроизведения физического состояния
металлов, обусловленной в основном наличием напряжений во всех металлах,
за исключением наиболее ковких.
Известны электроды, предназначенные для измерения давления кислорода и двуокиси углерода [19; 2, стр. 497-515]. Электрод для определения давления CO2 относится к погруженному типу; он разделен на две части мем-браной, проницаемой для СО2 и не проницаемой для ионов раствора. Двуокись углерода, проникшая сквозь мембрану, растворяется в растворе бикарбоната натрия, который находится внутри электрода, и тем самым изменяет его рН. Новое, измеряемое значение рН есть функция РCO2. СО2-электроды использовались Муром и его коллегами [18] для определения содержания двуокиси углерода в морской воде и в глубоководных морских осадках.
Электроды, предназначенные
для измерения давления кислорода, действуют на том принципе, что
электролизный ток воды между инертными электродами при постоянном
напряжении зависит от концентрации растворенного кислорода.
В настоящее время намечается определенный прогресс в создании электродов, предназначенных для исследования водных растворов и других систем при повышенных температурах и давлениях. В своем обзоре современного состояния вопроса об измерениях э. д. с. при высоких температурах Литцке [13] указал на то, что с помощью соответствующих электродов в принципе возможно изучение всех тех параметров раствора при повышенной температуре, которые можно изучать при комнатной температуре, в том числе коэффициентов активности, констант равновесия и величин растворимости солей. Литцке провел исследование зависимости потенциала электродов Ag-AgCl и Hg-Hg2Cl2 от температуры и обнаружил, что поведение электрода Ag - AgCl до температур порядка 200° С чрезвычайно близко соответствует теоретическому и что после ввода эмпирических поправок его можно использовать до температуры 260° С. Температурный коэффициент этого электрода составляет приблизительно +0,3 мв на 1°С и почти не меняется с температурой. Вопрос о возможности применения электрода Ag-AgCl в качестве рН-электрода до температуры 250° С при повышении давления до 40 атм обсуждался также Янцем [10, стр. 226]. Измерение рН с помощью стеклянных электродов успешно осуществляется до температуры 150° С и давления 1000 атм [12].
Наконец, существуют
неводные системы электролитов, которые представляют значительный интерес и
требуют детального изучения при высоких температурах. В первую очередь это
солевые расплавы. Техника проведения измерений и способы интерпретации
результатов при исследовании расплавленных солей имеют много общего с
методикой изучения водных растворов электролитов, но в ряде деталей
существенно от нее отличаются. Вопрос о применении электродов при изучении
систем с расплавленными солями подробно обсуждается Лайти [11, гл. 12] и
здесь не рассматривается.
Измерение рН раствора производится относительно эталонных буферных растворов, а при соблюдении ряда условий величина рН может быть приравнена к -lg [H+]. Окислительный потенциал Eh соответствует потенциалу полуэлемента, измеренному относительно стандартного водородного полуэлемента, потенциал которого условно считается равным нулю.
Измерение Eh и рН с геологическими целями наталкивается на ряд трудностей, преодоление которых требует соблюдения специальных мер предосторожности. Некоторые из возникающих затруднений мы рассмотрели. Большая часть известных в литературе измеренных значений Eh и рН относится к почвенным и водным системам, которые либо уже в природном состоянии находились в тесном контакте с атмосферой, либо соприкасались с воздухом после взятия пробы, но до того, как производилось измерение, или же в самый момент измерения. В настоящее время необходимо так усовершенствовать методику ввода электродов в природные среды, чтобы не допускать загрязнения этих сред. Приведены примеры исследований свободных и поровых вод в горных породах и водных осадках; результаты этих исследований представляют большую ценность для геохимиков, но при условии исключения ошибок в их интерпретации.
Огромные перспективы
раскрываются в области создания электродов, обладающих избирательной
чувствительностью к индивидуальным катионам и анионам. Прогресс,
наблюдающийся в создании электродов, предназначенных для изучения систем
при повышенных температурах и давлениях, обещает богатые возможности для
проведения исследований в геологических целях.
1. B a t e s R. G. Eloctrometric рН Determinations, New
York, Wiley (313), 1954.
2. С a t e r D. В., S i 1 v e r I. A. In Ives
D. J. G., Janz G. J. (eds.), Reference Electrodes, New York, Academic,
497-515, 1961.
3. С 1 a r k W. M. Oxidation-Reduction Potentials of
Organic Systems, Baltimore, Williams and Wilkins, 1960.
4. Г е р м а н
о в А. И., В о л к о в Г. А., Л и з и т з и н А. К., С е р е б р е н н и к
о в В. С. Геохимия, 3, 322, 1959.
5. G 1 a s s t о n e S. An
Introduction to Electrochemistry, New York, Van Nostrand (ch. 8), 1942.
(Есть русский перевод: Г л е с с т о н С. Введение в электрохимию, M., ИЛ,
1951.)
6. G о 1 d V. рН Measurement, New York, Wiley, 1956.
7. G o r
h a m E. Ecology, 41, 563, 1960.
8. H a u s e r E. A., R e e d С. E.
Soil Sci., 59, 175, 1937.
9. I v e s D. J. G., J a n z G. J. (eds.).
Reference Electrodes, New York, Academic (161), (ch. 7), 1961.
10. J a
n g G. J. In Ives, Janz, Reference Electrodes, New York, Academic, 226,
1961.
11. L a i t y R. W. In Ives, Janz, Reference Electrodes, New
York, Academic, ch. 12.
12. L e P e i n t r e M., M a h i e u C., F o u
r n i e R. Commissariat a L'Energie Atomique de France, Rapport No. 1951,
1961.
13. L i e t z k e M.H. Am. Inst. Chem. Engrs., Nuclear Eng. and
Sci. Congress, Preprint 223, 1955.
14. M a n h e i m F. Stockholm
Contributions in Geology, 8, 27, 1961.
15. M a r s h a 11 С f. С. E., В
e r g m a n W. E. Journ. Phys. Chem., 46, 52, 1942.
16. M a t t о с k
G. рН Measurement and Titration, London, Heywood (172-173), (395),
1961.
17. M e r k le F. G. Oxidation-reduction processes in soils, in
Chemistry of the Soil, Firman E. Bear (ed.) (АСА Monograph 126), New York,
Reinhold, 200-218, 1955.
18. M о о r e G. W., R о b e r s о n C. E., N
у g r e n H. D. U. S. Geol. Surv. Prof. Paper 450B, B-83, 1962.
19. S e
v e r i n g h a u s J. W., В r a d 1 e у A. F. Journ. Appl. Phys., 13,
515, 1958.
20. S i e v e r R., G a r r e 1 s R. M., Kanwisher J.,Berner
R.A. Science, 134, 1071, 1961.
21. S t a r k e y R. L., W i g h t К. M.
Anaerobic Corrosion of Iron in Soils, New York, American Gas Association,
1946.
22. S w i f t E. H. A System of Chemical Analysis, New York,
Prentice-Hall, 540, 1939.
23. W e у 1 Р. К. Journ. Geol., 69, 32,
1961.
24. W о о 1 m e r R. F. (ed.). A Symposium on рН and Blood Gas
Measurement, Boston, Little, Brown, 1959.
25. Z о В e 1 1 С. E. Bull.
Am. Assoc. Petrol. Geol., 30, 477, 1946.
B a a s B e c k i n g L.G. M., К a p 1 a n I. R., M о о r
e D. Limits of the natural environment in terms of рН and
oxidation-reduction potentials, Journ. Geol., 68, 243, 1960.
B a t e s
R. G. Electrometric рН Determinations, New York, Wiley, 1954.
G l a s s
t o n e S. An Introduction to Electrochemistry, New York, Van Nostrand,
1942. (Есть русский перевод: Г л е с с т о н С. Введение в электрохимию,
M., ИЛ, 1951.)
I v e s D. J. G., J a n z G. J.. (eds.). Reference
Electrodes, New York, Academic, 1961.
M t o k G. рН Measurement and
Titration, London, Heywood, 1961.
S t a r k e y R. L., Wight K. M.
Anaerobic Corrosion of Iron in Soils, New York, American Gas Association,
1946.
Z о В e 11 С. E. Studies on redox potentials of marine sediments.
Bull. Am. Assoc. Petrol. Geol., 30, 477, 1946
|
|
|
|
[Содержание] [Глава 4] [Глава 6] |