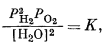
| Р.М. Гаррелс, Ч.Л. Крайст | Растворы, минералы, равновесия |
|
|
|
|
[Содержание] [Глава 5] [Глава 7] |
|
|
|
|
Равновесные соотношения
между минералами при 25° С и 1 атм общего давления обусловливаются
реакциями первого типа, т. е. реакциями с участием только твердых веществ.
Графически изобразить эти соотношения невозможно, так как они зависят
только от температуры и давления. Лишь в редких случаях свободная энергия
такой реакции при подобных произвольно выбранных условиях равна нулю.
Однако реакцию второго типа - с участием газовой фазы любой активности -
можно представить графически в виде функции активности данной газовой
фазы. В условиях интересующих нас низких температур и давлений активность
газовой фазы непосредственно определяется величиной ее парциального
давления. Практически это справедливо для всех газов, ибо они в таких
условиях близки к идеальному. Соотношения между фугитивностью, активностью
и давлением подробно были рассмотрены в гл. 2.
Из всех химических соотношений наибольший интерес для геологов представляет устойчивость воды. Предполагая существование равновесия между водой и продуктами ее диссоциации - водородом и кислородом, можно написать
| 2H2Oжидк = 2H2 газ + O2 газ. | (6.1) |
Константа равновесия этой реакции равна
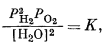 |
(6.2) |
но для почти чистой воды [Н2О] @ 1, и поэтому
| P2H2PO2 = K. | (6.3) |
Соотношение свободных энергий для уравнения (6.1) будет следующим:
| 2DF°обр H2 + DF°обр O2 - 2DF°обр H2O = DF°реакции. | (6.4) |
Подставив численные значения этих величин, получим
| 0 + 0 + 113,4 = DF°реакции. | (6.5) |
Теперь, исходя из зависимости между стандартной свободной энергией реакции и константой равновесия, по которой DF°реакции = 4.364 lg K, определяем
113,4 = -1,364 lg K,
K =
10-83,1.
Из уравнения (5.3) находим
| P2H2PO2 = 10-83,1. | (6.6) |
Таким образом, степень диссоциации воды на водород и кислород при комнатной температуре ничтожно мала. Тем не менее, допуская наличие равновесия, для характеристики пределов устойчивости воды можно использовать парциальные давления кислорода и водорода. Если парциальное
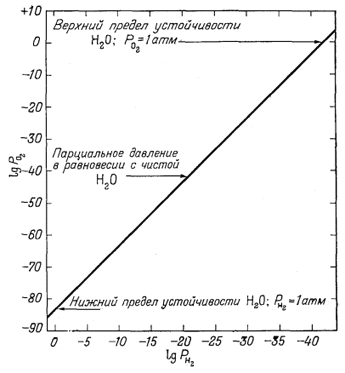 |
| Фиг. 6.1. Парциальные давления кислорода и водорода в условиях равновесия с водой при 25° С и примерно 1 атм общего давления. |
давление одного из газов (водорода или кислорода) в условиях земной поверхности превысит 1 атм, т. е. будет большим, чем атмосферное давление, то из воды начнет выделяться другой газ (кислород или водород соответственно), таким образом, вода будет разлагаться и поставлять (в атмосферу) дополнительные количества кислорода и водорода. Если РO2 = 1, то
| P2H2 = 10-83,1, PH2 = 10-41,5. | (6.7) |
Когда РH2 = 1, то
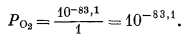 |
(6.8) |
Какими бы ни были в
отдельности заданные парциальные давления водорода или кислорода,
равновесное их отношение (с водой) будет вполне определенным. Для
дальнейшего изложения целесообразно построить график зависимости
РO2 от РH2 прн
равновесии с водой: если известно давление одного из этих газов, то
давление другого можно определить, не прибегая к специальным вычислениям
(фиг. 6.1).
Таким же образом можно рассчитать состояния устойчивости среди окислов железа, которые представляют определенный минералогический интерес. Прежде всего надо составить реакции их образования из соединений железа и газообразного кислорода, причем желательно учесть все перестановки и комбинации:
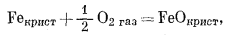 |
(6.9) |
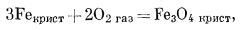 |
(6.10) |
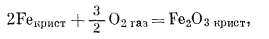 |
(6.11) |
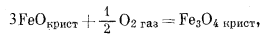 |
(6.12) |
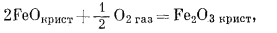 |
(6.13) |
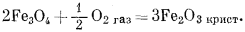 |
(6.14) |
Поскольку активность кристаллических веществ равна единице, каждая реакция будет находиться в равновесии при конкретном парциальном давлении кислорода. Необходимые вычисления иллюстрируются расчетом РO2 для равновесного состояния в реакции (6.14):
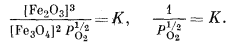 |
(6.15) |
Стандартная свободная энергия этой реакции такова:
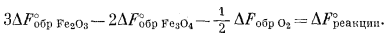 |
(6.16) |
После подстановки численных значений получим:
 |
|
| DF°реакции = -46,5 ккал. | (6.17) |
Отсюда
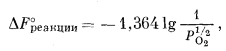 |
|
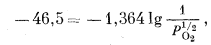 |
|
| PO2 = 10-68,2 атм. | (6.18) |
В табл. 6.1 приводятся результаты аналогичных вычислений по всем упомянутым выше реакциям.
Равновесные соотношения между этими соединениями выявляются еще лучше, если нанести соответствующие значения на линейный график давлений (фиг. 6.2). Теперь, начиная с нижней части графика, можно проследить за результатами, которые имели бы место при воздействии на металлическое железо кислорода с возрастающим парциальным давлением. (При этом предполагается настолько медленное повышение давления, что сохраняется приблизительное равновесие.) Однако подобный эксперимент провести нельзя
Таблица 6.1
| Реакция | PO2 | lg PO2 |
| Feкрист + 1/2O2 газ = FeОкрист | 10-85,6 | -85,6 |
| 3Feкрист + 2O2 газ
= Fe3O4
крист 2Feкрист + 3/2O2 газ =Fe2O3 крист |
10-88,9 10-86,6 |
-88,9 -86,6 |
| 3FeOкpиcт + 1/2O2 газ = Fe3O4 крист | 10-98,5 | -98,5 |
| 2FеОкрист + 1/2О2 газ = Fe2О3 крист | 10-88,4 | -88,4 |
| 2Fe3O4 крист + 1/2O2 газ = 3Fe2O3 крист | 10-68,2 | -68,2 |
из-за слишком низких давлений кислорода. Вычисленные значения давления, хотя и не могут быть реализованы при действительном окислении, все же дают весьма полезные ориентировочные данные.
Первая реакция, с которой мы встречаемся на графике,- реакция превращения FeO в Fе3O4 - безусловно метастабильна, так как FeO вообще не может окисляться в Fе3O4, пока не окислится все железо. Таким образом, железо будет устойчивым до тех пор, пока PO2 не достигнет значения 10-89, при котором Feкрист и Fе3O4 крист находятся в равновесии. При значении РО2 = 10-88 железо будет переходить в Fе3O4. Следующая реакция (окисление железа до Fе2O3) также метастабильна, ибо железо окисляется до магнетита раньше, чем до FeO. Другими словами,
4FeOкрист 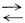 Fe3O4 крист +
Feкрист. Fe3O4 крист +
Feкрист. |
(6.19) |
Таким образом, мы выражаем это соотношение в виде реакции между твердыми веществами и находим, что DF°реакции отрицательна, а FeO при комнатной температуре будет необратимо переходить (диспропорционировать) в мaгнетит и металлическое железо. В связи с этим FeO не обладает полем устойчивости. Вообще существует много способов проверки метастабильных соотношений, но самым верным критерием может служить РO2.
Следуя далее вверх по линейному графику РO2, мы встречаемся с последней реакцией - окислением Fe3O4 в Fe2О3.
Теперь мы можем построить упрощенный линейный график с учетом только стабильных фаз Fe, Fe3O4 и Fe2O3, и на нашу долю выпадает первый успех, связанный с использованием РO2, - мы получаем возможность непосредственно сравнить равновесное значение РO2 для окислов железа и для воды (фиг. 6.3). Хотя, по-видимому, значение РO2, равное 10-89, само по себе почти не имеет физического смысла, но при сравнении его с пределами устойчивости воды можно убедиться в том, что в условиях земной поверхности металлическое железо в присутствии воды неустойчиво и что, кроме того, магнетит окисляется до гематита близ нижнего предела устойчивости воды. В связи с этим гематит, хотя и представляет собой соединение окисно-го железа с кислородом, все же, очевидно, служит плохим индикатором среды, будучи устойчивым в весьма широких пределах окислительных условий. Вместе с тем магнетит можно было бы принять за окисленное соединение, так
как две трети его железа трехвалентны. Однако магнетит устойчив только в сильно восстановительной среде и не восстанавливается самопроизвольна в присутствии воды и водорода при давлении 1 атм.
Фиг. 6.3 характеризует
такие взаимоотношения между железом, водородом и кислородом, которые можно
представить также в виде трехкомпонентной диаграммы состава Fe -
O2 - Н2. Примером подобной диаграммы служит фиг.
6.4, соединительные линии которой проведены по данным, снятым с графика
фиг. 6.3. В нижней части фиг. 6.3 сосуществуют железо и водород, а вода
неустойчива. Таким образом, на фиг. 6.4 этому полю соответствует
соединительная Линия между железом и водородом. Это поле на фиг. 6.3 не
зависит от количества присутствующего железа (важен лишь сам факт наличия
элементарного Fe), что и отражено в широком диапазоне составов,
обозначенном упомянутой соединительной линией на фиг. 6.4. Трехфазовое
поле Fe - Н2 - Fe3O4 точно так же на фиг.
6.3 отражается линией, показывающей, что при совместном существовании этих
трех фаз давления кислорода и, водорода инвариантны. Заметим, что при
сопоставлении фиг. 6.3 и 6.4 удобно определять частные значения давления
газов в трехфазовых полях и пределы давлений, допустимых для двухфазовых
ассоциаций.
Простота графического изображения взаимоотношений между соединениями железа и кислорода, когда можно использовать даже линейные графики, естественно предполагает возможность, графического изображения реакций с парциальными давлениями двух газов в качестве переменных. Для минералов железа наиболее интересно использовать такие газы, как CO2 и S2. Начнем с CO2 и напишем реакции перехода от металлического железа и его окислов к одному и тому же карбонатному минералу - сидериту:
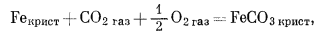 |
(6.20) |
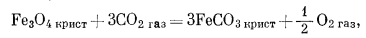 |
(6.21) |
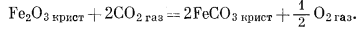 |
(6.22) |
Для реакции (6.20) имеем
 |
Отсюда
| -66,80 = -l,364 lg K, | |
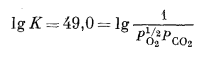 |
и
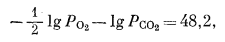 |
|
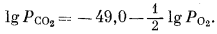 |
Подобные расчеты для реакций (6.21) и (6.22) дают следующие соотношения:
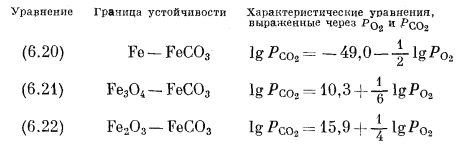
На графике, осями координат которого служат lg PO2 и lg PCO2, границы между соединениями в каждой из трех пар представляют собой прямые линии с наклоном соответственно в - 1/2, + 1/6 и + l/4. Эти границы и показаны на фиг. 6.5 вместе с границами устойчивости окислов железа и воды. Нанести эти прямые на график очень просто. Надо задаться произвольным значением РCO2, определить соответствующую величину РO2 и затем провести через полученную точку линию с надлежащим наклоном.
Рассматривая фиг. 6.5, можно установить метастабильность некоторых соотношений на отдельных участках диаграммы. Например, граница между Fe и FeCO3 при давлении кислорода выше 10-88 отчетливо метастабильна, поскольку при большем давлении железо неустойчиво по отношению к окислам. Исключив метастабильные соотношения, получаем окончательную диаграмму, приведенную на фиг. 6.6. Здесь уже можно обозначить поля устойчивости. При сравнении фиг. 6.5 и 6.6 видно, что используемые значения свободной энергии по меньшей мере сопоставимы между собой. Обратите внимание, как на фиг. 6.5 пересекаются линии уравнений (6.14), (6.21) и (6.22), а также уравнений (6.21), (6.20) и (6.10). Треугольники расхождения в указанных местах пересечения свидетельствуют о том, что в определении значений свободной энергии для одного из уравнений допущена ошибка. На фиг. 6.6 граница между Fe2O3 и FeCO3 при значениях РCO2 выше 10° обозначена штриховой линией, что указывает на верхний предел применимости расчетов по парциальным давлениям с использованием данных, справедливых только при 25° и 1 аmм общего давления. При вычислениях границ устойчивости фаз активности твердых веществ для любого общего давления, принимаются равными единице. Такой прием не противоречит результатам, рассмотренным в гл. 9, где показано, что относительные активности твердых веществ в любой данной реакции существенно не отклоняются от единицы при увеличении общего давления от 1 атм до давления порядка 50 аmм. Кроме того, сделано допущение о равенстве Ргаз = aгаз при всех значениях Pгаз. Диаграмма подобного типа действительна только для рассмотрения соотношений между учтенными компонентами: с ее помощью нельзя установить, есть ли в системе такие компоненты, которые не учтены, но по отношению к которым будут неустойчивы рассматриваемые компоненты. Это,
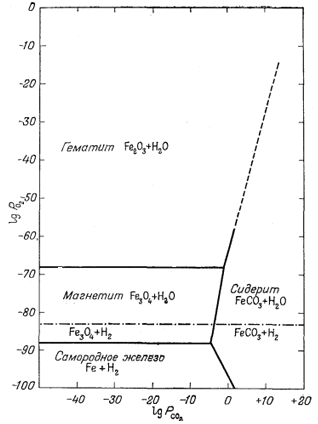 |
| Фиг. 6.6. Соотношения устойчивости некоторых соединений железа как функция PO2 и PCO2 при 25° С и низком общем давлении. На диаграмму наложены также пределы устойчивости воды. |
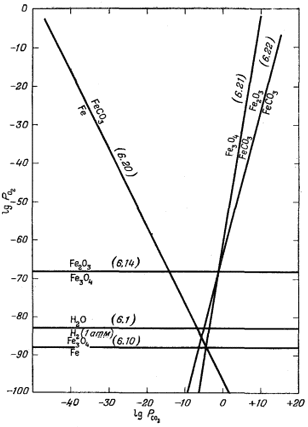 |
| Фиг. 6.5. Графическое изображение уравнений устойчивости соединений железа в зависимости от PO2 и PCO2 при 25° С. |
в частности, обнаруживается при наложении диаграммы Fe -
O2 - СО2 на диаграмму H2O -
H2; не исключено, что Fe2O3 и
Н2О могут быть неустойчивы в связи с реакцией
Fe2О3 крист + Н2Ожидк =
2FеООНкрист. А раз так, то поле гематит - вода заместилось бы
полем гётит - вода, причем последнее могло бы оказаться больше показанного
поля гематит - вода. При простом наложении диаграмм устойчивости,
построенных в одинаковых координатах, всегда следует выяснить, не будет ли
взаимодействие между сопоставляемыми компонентами приводить к образованию
каких-то других, новых компонентов. Трудно переоценить тот факт, что с
помощью рассмотренных выше методов можно построить вполне
удовлетворительные диаграммы соотношений устойчивости исследуемых
компонентов, но все же у нас нет гарантии, что учтенные соотношения
исчерпывают все соотношения, которые следовало бы принять во внимание.
Как правило, более надежный ответ скорее можно получить на вопрос, какие
компоненты не могут находиться в равновесии (например, Fe и
H2O), чем на вопрос, какие могут (например,
Fе2О3 и H2O). Таким образом, самый верный
рабочий метод состоит в проверке равновесности фактических минеральных
ассоциаций.
Можно было бы построить большое количество диаграмм подобного типа, если бы наши интересы не ограничивались только кислородно-карбонатными соотношениями для отдельных элементов периодической системы (и если бы имелись все данные по свободным энергиям). В этой связи особенно большой интерес для геолога представляют минералы меди, что обусловлено экономической значимостью процессов окисления и вторичного обогащения. К тому же на них удобно демонстрировать результаты взаимодействия с водой. Главными соединениями в нашей системе будут самородная медь Сu, куприт Сu2O, тенорит СuО, малахит Сu2(ОH)2СО3 и азурит Сu3(ОН)2(СО3)2. Если ограничиться значениями РO2, лежащими в поле устойчивости воды (РO2 = 10-83,1 - 100), то мы получим возможность исследовать взаимодействие между различными соединениями меди с помощью уравнений,, учитывающих почти чистую жидкую воду. Природные растворы, циркулирующие в зоне окисления медных месторождений, обычно разбавлены, в связи с чем их активность может быть приравнена к активности чистой воды.
Ниже приведены реакции взаимодействия в нашей системе (здесь исключены метастабильные реакции, как это было сделано и для соединений железа):
 |
(6.23) |
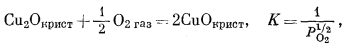 |
(6.24) |
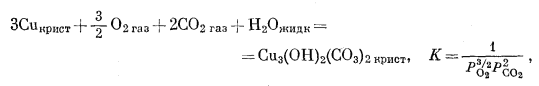 |
(6.25) |
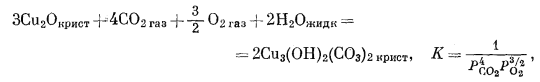 |
(6.26) |
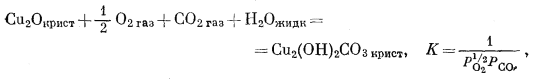 |
(6.27) |
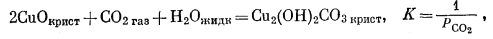 |
(6.28) |
 |
(6.29) |
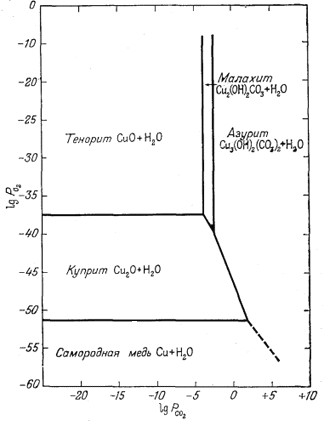 |
| Фиг. 6.7. Устойчивость соединений меди как функция РO2 и РCO2 при 25° С и 1 атм общего давления. Для всех случаев подразумевается наличие чистой жидкой воды. |
Этим реакциям соответствуют следующие уравнения:
| Уравнение | Граница устойчивости | Характеристические уравнения, выраженные через РO2 и РCO2 |
| (6.23) | Сu - Cu2O | lg РO2 = -51,30 |
| (6.24) | Cu2O - СuО | lg РO2 = -37,6 |
| (6.25) | Сu - Сu3(ОН)2(СО3)2 | lg РCO2 = -36,9 -3/4 lg РO2 |
| (6.26) | Сu2О - Сu3(ОН)2(СО3)2 | lg РCO2 = -17,6 - 3/8 lg РO2 |
| (6.27) | Cu2O - Сu2(ОН)2СО3 | lg РCO2 = -22,7- 1/2 lg РO2 |
| (6.28) | СuО -Сu2(ОН)2СО3 | lg РCO2 = -3,8 |
| (6.29) | Сu2(ОН)2СО3 - Сu3(ОН)2(СО3)2 | lg РCO2 = -2,5 |
Результаты
графического изображения полученных уравнений приведены на фиг. 6.7.
Общие закономерности удивительным образом сходны с теми, которые были
выявлены для окислов и карбоната железа и представлены на фиг. 6.6.
Небольшое отличие заключается в появлении еще одного карбонатного
соединения. Новая диаграмма подводит нас к некоторым интересным выводам. В
поверхностных условиях при высоком значении
РO2 и при РCO2,
равном 10-3,5, малахит устойчив относительно азурита. Азурит
может стать устойчивым только при повышении
РCO2 или при уменьшении активности воды
[уравнение (6.29)]1 (стр.142). Таким образом,
в сухом полуаридном климате относительная влажность воздуха настолько
мала, что оказывается вполне возможным устойчивое существование азурита.
Но если образцы азурита попадают в условия более высокой влажности, то он
начинает переходить в малахит. Этим и объясняется зеленый цвет неба на
многих картинах, вывезенных из стран, где азурит служит устойчивым
красителем.
С помощью диаграмм парциальных давлений также удобно рассмотреть взаимоотношения между сульфидами и окислами металлов. Для характеристики подобных соотношений мы используем двухатомную газообразную серу. Молекулярные частицы газообразной серы при 25° С вряд ли устойчивы; более вероятно, что в таких условиях сера находится в виде частиц с большим числом атомов, чем S2. Однако для наших целей выбор газовых частиц не имеет существенного значения, поскольку они используются только в качестве критерия, позволяющего сравнивать реакции минералов железа с реакциями между другими минералами. Кроме того, определив устойчивые соотношения, выраженные в виде функции какой-либо удобной пары переменных величин, вроде РO2 и PS2, мы можем при желании пересчитать полученные отношения, выразив их в виде функции других газов. Для этого достаточно составить реакции взаимодействия между первоначально принятыми и новыми переменными.
Как обычно, прежде всего напишем реакции между минералами и газами. Методика теперь уже ясна. Сначала мы пишем уравнения для реакций, включающие только по одной переменной:
| 3Feкрист + 2O2 газ = Fe3O4 крист, | (6.10) |
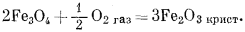 |
(6.14) |
| 2Feкрист + S2 газ = 2FeSкрист, | (6.30) |
| Feкрист + S2 газ = FeS2 крист, | (6.31) |
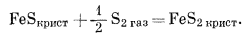 |
(6.31a) |
Затем следуют реакции с участием обеих переменных:
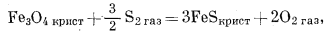 |
(6.32) |
| Fe3O4 крист + 3S2 газ = 3FeS2 крист + 2O2 газ, | (6.33) |
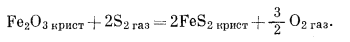 |
(6.34) |
|
1 (стр.142) Азурит в природе очень часто переходит в малахит, который образует псевдоморфозы по азуриту. Обратный переход без образования растворимых комплексных карбонатных соединений неизвестен.- Прим. ред., |
Обратите внимание, что здесь мы смогли учесть предыдущий опыт исследования соотношений между окислами железа (фиг. 6.2) и из дальнейшего анализа соотношений между железом и кислородом исключили все реакции, кроме стабильных. При составлении уравнений реакций в системах железо - сера и железо - кислород - сера для начала следует учесть все реакции, которые нам подсказывают минералогические наблюдения. Здесь отсутствует только одна из них - реакция между Fe2O3 и S2 с образованием FeS.
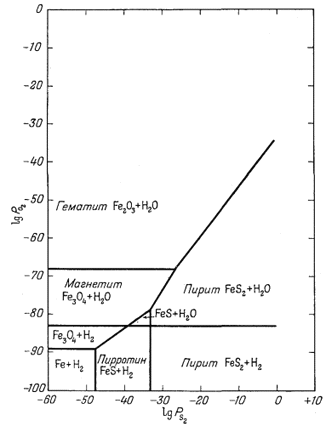 |
| Фиг. 6.8. Устойчивость некоторых окислов и сульфидов железа как функция PO2 и РS2 при 25° С и 1 аmм общего давления. На диаграмме показана также граница устойчивости воды. |
Если ее рассчитать и нанести на диаграмму, то можно обнаружить, что она метастабильна (впрочем, об этом можно догадаться и на основании минералогических соотношений). Кроме того, мы ограничили наши интересы только сульфидами, хотя в результате взаимодействия железа, серы и кислорода могут образовываться также сульфаты и некоторые соединения серы с кислородом. Однако мы сознательно ограничиваем свое. внимание сульфидами и не собираемся исследовать все взаимодействия, возможные в системе железо - кислород - сера.
И еще одно последнее предостережение, которое мы время от времени будем повторять. Наши вычисления сделаны для соединения FеSкрист, истинный состав которого отвечает формуле Fe1-xS, а не FeS. Поэтому принятая величина свободной энергии относится к частному составу Fе0,95S, как это дано в таблице свободных энергий в приложении 2, и не может считаться справедливой для любого состава. Хотя обычно ошибка, связанная с отклонением этих величин от строгих стехиометрических отношений, невелика, ее необходимо принять во внимание и оценить, приступая к действительно серьезным расчетам.
На фиг. 6.8 сведены
результаты определения констант равновесия для уравнений (6.10), (6.14) и
(6.30) - (6.34). Даже несмотря на то, что эта диаграмма составлена для 25°
С, она указывает на самые обычные для геолога возможные и запрещенные
ассоциации. Например, возможна тройная ассоциация пирротин - пирит -
магнетит, и невозможно совместное выделение пирротина и гематита.
Положение границы устойчивости воды также говорит о многом. Равновесия,
изображенные на диаграмме, не зависят от воды, а сама вода не является
необходимым спутником рассматриваемых минералов железа. Однако следует
отметить, что пирротин и вода могут сосуществовать при 25° С только в
очень ограниченных условиях.
Анализ системы с медью аналогичен только что разобранному случаю. В ней участвуют следующие реакции:
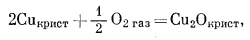 |
(6.23) |
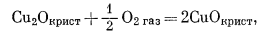 |
(6.24) |
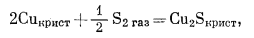 |
(6.35) |
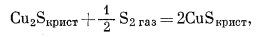 |
(6.36) |
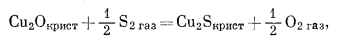 |
(6.37) |
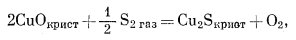 |
(6.38) |
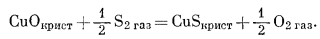 |
(6.39) |
В приведенных реакциях не участвует одно интересующее нас соединение, а именно минерал дигенит Cu9S5. В справочной литературе данные по свободной энергии дигенита отсутствуют. Поэтому мы не учитываем это соединение, но оговариваемся, что были бы рады учесть и его. В отношении Cu2S следует сделать то же предостережение, что и в отношении FeS, ибо состав халькозина обычно не соответствует стехиометрической формуле.
Графические построения фиг.
6.9 основаны на константах равновесия, вычисленных по уравнениям (6.23),
(6.24) и (6.35) - (6.39). Эта диаграмма очень похожа на соответствующую
диаграмму для системы Fe - S2 - О2.
Устойчивые соотношения между соединениями железа могут быть выражены как в виде функции РO2 и PS2, так и в виде функции PO2 и PCO2. Это естественно наводит на мысль о возможности изображения тех же соотношений в виде функции сразу всех трёх переменных. Результат объединения диаграмм фиг. 6.8 и 6.6 приведен на фиг. 6.10. Построение новой диаграммы
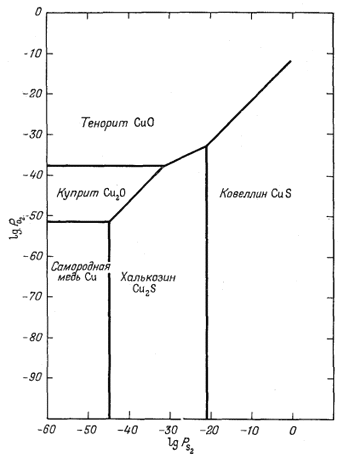 |
| Фиг. 6.9. Соотношения устойчивости некоторых окислов и сульфидов меди как фукция PO2 и PS2 при 25° С и 1 атм общего давления. |
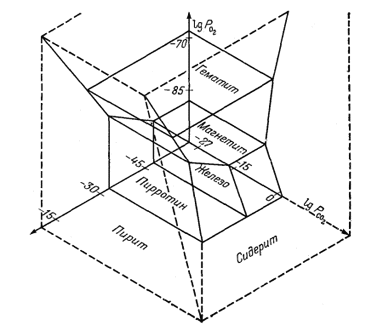 |
| Фиг. 6.10. Соотношения устойчивости некоторых соединений железа как функция PO2, PCO2 и PS2 при 25° С и 1 атм общего давления. |
довольно просто и заключается в следующем. Строим оси координат PS2 и РCO2 под прямым углом к общей оси РO2 и затем находим линии пересечения плоскостей. Для этой системы необходимо составить еще одно новое уравнение, выражающее соотношения пирита и сидерита:
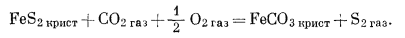 |
(6.40) |
Это уравнение определяет
единственную границу (плоскость раздела), которая не составляет прямого
угла ни с одной из осей координат, так как в этой реакции участвуют все
три переменные.
Соотношения между некоторыми окисными соединениями меди, гидро-оксикарбонатами и сульфидами также можно выразить в виде функции трех парциальных давлений; соответствующая диаграмма приведена на фиг. 6.11.
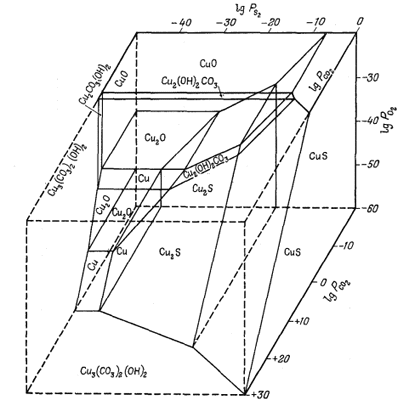 |
| Фиг. 6.11. Соотношения устойчивости некоторых минералов меди как
функция PO2,
РCO2 и PS2
в присутствии чистой воды при 25° С и 1 атм (и выше) общего
давления. Значения PCO2 экстраполированы ва пределы имеющихся данных (Дж. Андерсон, геологический отдел Гарвардского университета, 1958). |
Эта диаграмма отражает и соотношения соединений меди при
давлениях CO2, намного превышающих те пределы, для которых эти
данные могут быть использованы. Все таки приведенная диаграмма дает ясное
представление о том, какое высокое давление CO2 нужно создать,
чтобы превратить сульфиды в гидрокарбонаты при низком
парциальном давлении кислорода. В остальном в пределах обычных значений
парциальных давлений эта диаграмма вполне удовлетворительна.
Так как диаграммы
парциальных давлений для минералов с различными минералообразующими
элементами можно выразить через одни и те же переменные, часто
представляется интересным наложить такие диаграммы друг на друга и
сравнить положение полей устойчивости сульфидов, окислов и карбонатов
различных металлов.
На фиг. 6.12 совмещены диаграмма РO2 - PS2 Для марганца с ранее построенной такой же диаграммой для железа (фиг. 6.8). Но это не простое наложение двух диаграмм друг на друга, так как в систему вносится новое
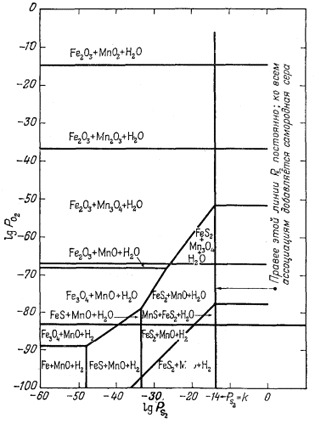 |
| Фиг. 6.12. Устойчивость некоторых соединении железа и марганца
как функция Р2 и РO2
при 25° С и 1 атм общего давления. Пределы устойчивости самородной серы и воды ограничивают возможные значения PO2 и PS2 (Дж. Рейтцел, геологический отдел Гарвардского университета, 1958). |
ограничение. Парциальное давление S2 в равновесном состоянии с алабандином MnS при низких значениях РCO2 должно превышать 1 атм. Это заставляет нас вспомнить, что давление пара твердой серы при низких температуpax, вероятно, довольно мало и его стоит определить, если рассматривать в виде возможной фазы твердую серу. Итак,
| S2 газ = 2Sромбич, | (6.41) |
| 2DF°обрSкрист - 2DF°обрS2 газ = DF°реакции, | |
| 0 - 19,13 = -19,13, -19,13 = - 1,364 lg К, | |
| lg K = 14 = lg 1/PS2, lg PS2 = - 14. |
Таким образом, давление пара S2 в условиях
равновесия с самородной серой равно 10-14 и не может превысить
эту величину, ибо активность S2 определяется наличием ее в
твердой фазе. Следовательно, не надо беспокоиться о всех тех компонентах,
которые устойчивы при значениях PS2,
превышающих 10-14, и при таком давлении к рассматриваемым
ассоциациям можно добавить серу. Этим подчеркивается как пригодность
подобных диаграмм для выяснения возможных и запрещенных ассоциаций, так и
опасность их использования в качестве прогнозных схем, так как иная,
казалось бы, допустимая ассоциация может оказаться метастабильной
относительно неучтенных компонентов. Вот некоторые важные особенности,
установленные с помощью этой диаграммы: 1) крайне ограниченное поле
сосуществования алабандина и воды согласуется с редкой распространенностью
алабандина в природе; 2) возможность сосуществования
Fе2О3 и МnО в ограниченных пределах изменения
давления кислорода; 3) возможность совместного нахождения
Мn3O4 и FeS2; 4) широкое поле
устойчивости Fе2О3, которое перекрывает ряд полей
окислов марганца. Помимо прочего, Мn3О4 и
Fе3O4, по-видимому, представляют собой невозможную
ассоциацию, хотя установленная разница в давлении кислорода между
пределами устойчивости этих соединений столь мала, что высказанное
заключение представляется сомнительным1 (стр.148).
Соотношения между окислами
и карбонатами железа и марганца показаны на фиг. 6.13. Она иллюстрирует
значительно большую устойчивость чистого карбоната марганца по отношению к
окислам марганца, чем карбоната железа по отношению к окислам железа.
Сопоставление особенностей поведения железа и марганца, с одной стороны,
служит нам напоминанием о возможном их взаимодействии с образованием,
например, соединения типа
(FеxМny)СО3, а с другой,- о
том, что мы рассматриваем все же две отдельные диаграммы, без учета
взаимодействия между сопоставляемыми компонентами. Вообще говоря, в
принятых нами условиях образование твердого раствора маловероятно.
Наложение диаграммы Fe -
О2 - S2 (фиг. 6.8) на диаграмму Сu - О2 -
S2 (фиг. 6.9) показано на фиг. 6.14. В этой совмещенной
диаграмме совершенно не учитываются соединения, содержащие одновременно
медь и железо, подобные халькопириту CuFeS2 или борниту
Cu5FeS4. Натарайан [3] попытался рассмотреть
подобные взаимоотношения, основываясь на
|
1 (стр.148) Высшие окислы Mn способны окислять FeO, являющийся компонентом Fe3O4, до Fe2O3.- Прим. ред. |
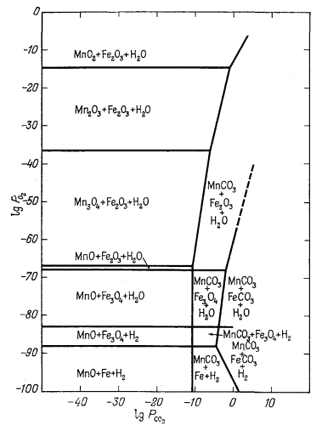 |
| Фиг. 6.13 Устойчивые соотношения окислов и карбонатов железа и
марганца как функция PO2 и
PCO2 при 25° С и 1 атм общего
давления. Здесь же показан предел устойчивости воды. Взаимодействие между соединениями железа и марганца не учитывалось(Дж. Рейтцел, геологический отдел Гарвардского университета, 1958) |
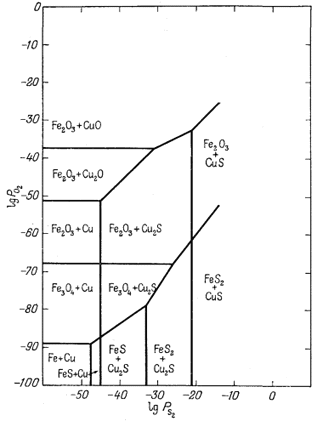 |
| Фиг. 6.14 Соотношения некоторых соединений в системе Fe - O2 - S2 и в системе Cu - O2 - S2, совмещенных в одном графике, как функция PO2 и PS2 при 25° С и 1 атм общего давления. Взаимодействие между двумя системами не учитывается. |
диаграммах Мак-Кинстри и Кеннеди [1, 2]; в этих работах собраны данные по природным ассоциациям минералов, возможным в разбираемой нами системе. Чтобы подойти к выяснению устойчивых соотношений компонентов при 25° С, Натарайан изучил минералогию зоны окисления и вторичного сульфидного обогащения. Диаграмма состава для системы Сu - Fe - S2 при 25° С в том виде, как она была составлена Натарайаном, показана на фиг. 6.15. Анализируя диаграмму в направлении, указанном длинной стрелкой (в сторону повышения содержания серы), мы встретим ряд реакций, для которых
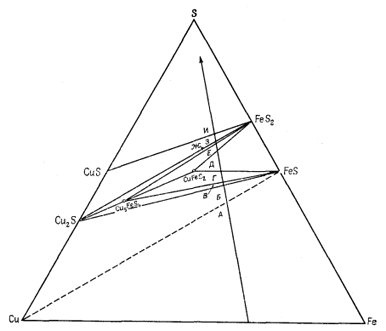 |
| Фиг. 6.15. Диаграмма устойчивых соотношении в
системе Сu - Fe - S при 25° С и 1 атм общего давления,
составленная Натарайаном. Существует некоторая неопределенность в отношении состава Cu2S и FeS при данной температуре. |
могут быть составлены соответствующие уравнения; последние мы обозначим буквами, проставленными на диаграмме состава около соответствующих соединительных линий.
Двигаясь от линии, соединяющей Сu и Fe, мы попадаем в трехфазовое поле Сu - Fe - FeS и затем достигаем линии Сu - FeS (ассоциация Сu - FeS в природе не известна; это, вероятно, обусловлено необходимостью низкого давления S2 при давлении О2 ниже того предела, который характеризует равновесие с водой). Отмеченное трехфазовое поле существует при постоянном PS2 и соответствует вертикальной линии на диаграмме РO2 - PS2. Эта линия определяется реакцией
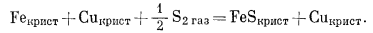 |
(A) |
Следующей будет реакция перехода от ассоциации Сu4-FeS к ассоциации Cu2S+FeS
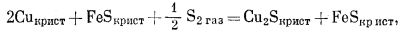 |
(B) |
и далее в той же последовательности:
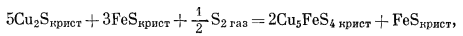 |
(C) |
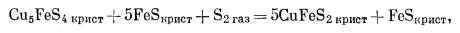 |
(D) |
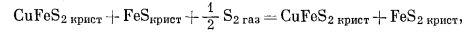 |
(E) |
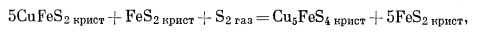 |
(F) |
 |
(G) |
 |
(H) |
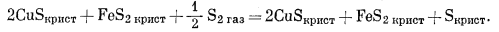 |
(I) |
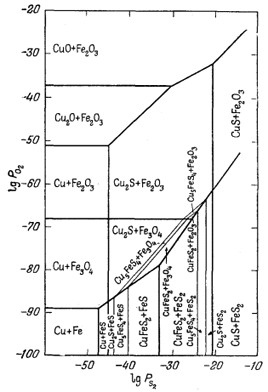 |
| Фиг. 6.16. Соотношения между некоторыми окислами и сульфидами
железа и меди при 25° С и 1 атм общего давления. Жирные линии - границы устойчивости, взятые из частных диаграмм PO2 - PS2 для железа и меди. Тонкие линии - соотношения, выведенные по ассоциациям минералов (Натарайан и Гаррелс, неопубликованные данные, 1958). |
У нас нет данных по свободной энергии образования Cu5FeS4, а для CuFeS2 они только приблизительны. Однако мы можем получить достаточно точные значения констант для всех перечисленных выше реакций. А каким образом - это лучше всего объяснит анализ фиг. 6.16, на которой изображены устойчивые соотношения, выведенные для всех соединений. Основой для построения этой диаграммы послужила фиг. 6.14, где были показаны поля устойчивости соединений с известными значениями свободных энергий. Итак, реакции (А) - (Н) дают последовательность, в которой будут образовываться минералы при увеличении PS2; благодаря этому мы можем определить истинное положение тонких линий в нижней части диаграммы, ориентируясь по известным границам устойчивости. Затем, используя дополнительные сведения по возможным ассоциациям, почерпнутые путем анализа четверной системы Сu - Fe - O2 - S2, необходимо уточнить положение каждой тонкой линии, отражающей новые равновесия. Определить границу устойчивости обычных ассоциаций CuFeS2 - Fе3O4 и CuFeS2 - Fe2O3 мы в состоянии, так как граничную линию для реакции Cu5FeS4 + 5FeS + S2 = 5CuFeS2 + FeS (D) можно провести на диаграмме с точностью до 1-2 логарифмических единиц PS2. Кроме того, поскольку наклон линий, отражающих все равновесия, известен вне зависимости от абсолютных их значений, а место границы примерно определено по PS2 для реакции (D), то можно установить и положение границы для реакции 5СuFеS2 + FeS2 + S2 = Cu5FeS4 + 5FeS2. Здесь следует указать, что любое существенное изменение положения этих двух границ приведет к "исчезновению" (на диаграмме) какой-либо известной природной ассоциации или же, наоборот, "обнаружит" наличие ассоциации, в действительности неизвестной.
Фиг. 6.16 не претендует на высокую точность изображения устойчивых соотношений для данной системы, но служит ценной рабочей схемой, с помощью которой можно исследовать природные соотношения минералов или анализировать данные экспериментов.
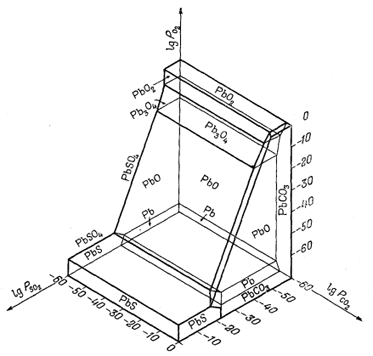 |
| Фиг. 6.17. Устойчивость некоторых соединений свинца при 25° С и
1 атм общего давления как функция
PO2, РCO2
и PSO2. В данном случае переменная PSO2 использована для того, чтобы показать возможность применения самых различных газов при характеристике минеральных равновесии. Обратите внимание, что PbS, PbSO4 и РbСО3 - фазы, которые могут существовать в близповерхностных условиях (Андерсон, геологический отдел Гарвардского университета, 1958). |
[На фиг. 6.17 показаны
соотношения в системе Рb - О2 - CO2 - S2,
включающей галенит PbS, церуссит PbCO3, англезит
PbSO4, платтнерит РbО2 и другие минералы свинца.-
Ред.]
В настоящей главе мы
разобрали ряд диаграмм, продемонстрировав тем самым, насколько
целесообразно выражать соотношения между минералами, используя в качестве
переменных величину парциального давления некоторых газов. Для геолога в
этом смысле наиболее важны О2, СО2 и S2.
Соотношения между окислами, карбонатами и сульфидами каждого металла можно
представить в виде отдельных диаграмм, а для уравнения такие диаграммы
можно накладывать друг на друга. Подобное наложение допустимо при
сопоставлении положений полей устойчивости минералов каждой из диаграмм и
не может быть истолковано как изображение устойчивых соотношений всех
возможных стабильных фаз. Что же касается разобранных диаграмм подобного
типа, то необходимо указать на три основных ограничения:
1) имеющиеся
данные пока недостаточны и не позволяют рассматривать изменения в составе
реальных минералов; 2) для геологов было бы весьма интересно рассматривать
взаимодействия (компонентов из разных систем), приводящие к образованию
новых минеральных видов; между тем простое наложение диаграмм в этом
случае не всегда может помочь; 3) хотя по парциальным давлениям газов
удобно сравнивать устойчивые соотношения различных минералов, все же
расчетные величины давлений столь малы (за исключением
PCO2), что почти не имеют физического смысла.
Вычисленные значения парциальных давлений нельзя проверить непосредственно
на эксперименте и нелегко сопоставить их с конкретными, наблюдаемыми в
поле условиями.
6.1. Рассчитайте равновесное парциальное давление
кислорода для реакции SnОкрист + 1/2О2 газ =
SnО2 крист при 25° С и общем давлении 1 атм.
Ответ:
РO2 = 10-90,5 атм.
6.2.
Какова величина парциального давления S2 газ в равновесии с
ромбической серой при 25° С и 1 атм общего давления? Ответ:
PS2 = 10-14,0 атм.
6.3.
Постройте диаграмму, иллюстрирующую устойчивые соотношения UО2
крист, UО3 крист и UО2СО3 в виде
функции lg PO2 и lg
PCO2.
1. M c К i n s t r y Н. Е. Phase assemblages in sulfide
ore deposits, N.Y. Acad. Sci., Ser. II, 20, 15-26, 1957.
2. M c K i n s
t r y Н. Е., K e n n e d y G.C. Some suggestions concerning the sequence
of certain ore minerals, Econ. Geol., 52, 379-390, 1957.
3. N a t a r a
j a n R. Неопубликованные данные. Department of Geology, Harvard
University, 1958.
D a r k e n L. S., G u r r у R. W. The Physical Chemistry
of Metals, New York, McGraw-Hill, 535 pp., 1953. (Есть русский перевод: Д
а р к е н Л. С., Г у р р и Р. В. Физическая химия металлов, М.,
Металлургиздат, 1960.)
S c h m i t t Н. Н. (е d.). Equilibrium Diagrams
for Minerals, Cambridge, Mass., The Geological Club of Harvard, 1962.
|
|
|
|
[Содержание] [Глава 5] [Глава 7] |